 C . 原子核内有8个中子的氧原子:
C . 原子核内有8个中子的氧原子: 



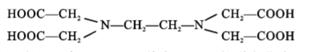
①EDTA 中电负性最大的元素是,其中 C原子轨道杂化类型为 ;
②EDTA 存在的化学键有 (填序号).
a. 离子键 b. 共价键 c. 氢键 d.σ键 e.π键 f. 配位键
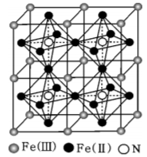
已知晶体的密度为ρg·cm-3 , 阿伏加德罗常数为 NA.
①该结构中单纯分析铁的堆积,其堆积方式为;
②该铁氮化合物的化学式为;
③计算 Fe(Ⅱ)构成正八面体的体积为cm3.
②元素W在周期表中的位置为,元素Y在周期表区。

①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2 ⑦氦气
这些物质中,只含共价键的是。只含离子键的是。既含共价键又含离子键的是。
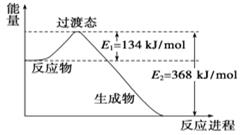

a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出