①引发Cl2→Cl +Cl
等
②链反应Cl +CH4→CH3
+HCl CH3
+Cl2→Cl
+CH3Cl 等
③终止Cl +Cl
→Cl2 Cl
+
CH3→CH3Cl 等
以下说法错误的是( )

| 实验操作和现象 | 实验结论 | |
| A | 加入少量硫酸铜可加快锌与稀硫酸的反应速率 | Cu2+是该反应的催化剂 |
| B | 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 无法证明溶液X中是否存在NH |
| C | 将苯加入到橙色的溴水中,充分振荡后静置,下层液体几乎无色 | 苯与Br2发生了取代反应 |
| D | 向淀粉水解后的溶液中加入碘水,溶液变蓝色 | 淀粉没有水解 |
下列说法错误的是( )

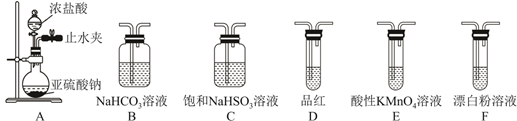
装置A中的试剂是。
①用棕色滴定管盛装AgNO3溶液,其原因是。
②该SO2Cl2产品的纯度为。
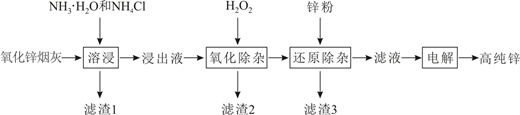
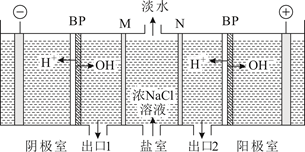
已知浸出液含[Zn(NH3)4]2+、[Cu(NH3)4]2+、AsCl 。
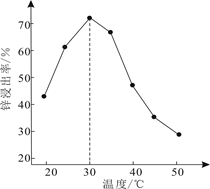
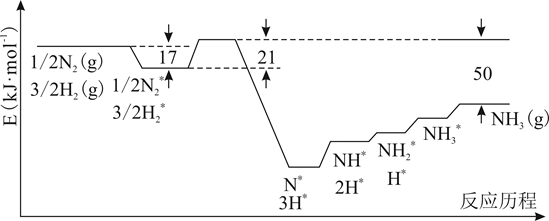
氨气的脱附是(填“吸热”或“放热”)过程,合成氨的热化学方程式为。
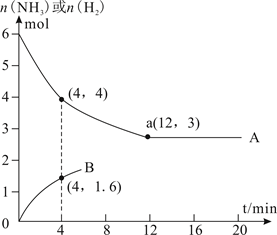
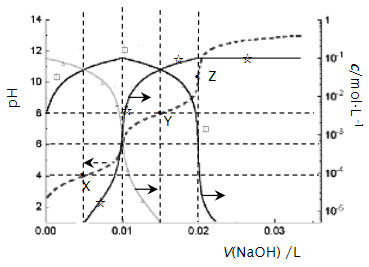
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2 , 试说明理由。
|
助剂 |
CO2转化率(%) |
各产物在所有产物中的占比(%) |
||
|
C2H4 |
C3H6 |
其他 |
||
|
Na |
42.5 |
35.9 |
39.6 |
24.5 |
|
K |
27.2 |
75.6 |
22.8 |
1.6 |
|
Cu |
9.8 |
80.7 |
12.5 |
6.8 |
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是。
|
氯化物 |
熔点/℃ |
沸点/℃ |
溶解性 |
|
TiCl4 |
-24 |
136 |
可溶于非极性的甲苯和氯代烃 |
|
TiCl2 |
1035 |
1500 |
不溶于氯仿、乙醚 |
①TiCl4与TiCl2的晶体类型分别是、。
②TiCl4与 互为等电子体,因为它们相同;
中心原子的杂化方式是。
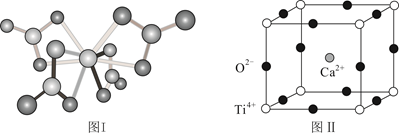
①设NA为阿伏加德罗常数的值,计算一个晶胞的质量为g。
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则 。
i.能发生银镜反应
ii.分子中含有三种化学环境不同的氢原子
iii. 不存在
![]() 结构
结构