
 加入大理石
B .
加入大理石
B .  闻气味
C . 测定溶液的pH
闻气味
C . 测定溶液的pH  D . 稀释浓硫酸
D . 稀释浓硫酸
 B .
B .  C .
C .  D .
D . 
| 实验方案 | 使用的试剂 | 判断的方法 |
| A | 铁粉 | 如果有气泡产生,表明盐酸已经过量 |
| B | pH试纸 | 如果pH<7,表明盐酸已经过量 |
| C | 硝酸银溶液 | 如果有白色沉淀产生,表明盐酸已经过量 |
| D | 紫色石蕊试剂 | 如果溶液变成红色,表明盐酸已经过量 |

|
| X | Y |
| A | CO | Ca(OH)2 |
| B | CO2 | NaOH |
| C | HCl | Ba(OH)2 |
| D | SO2 | NaOH |





|
质量分数 电流强度 |
2% |
3% |
4% |
|
Ca(NO3)2溶液 |
0.09A |
0.14A |
0.18A |
|
Ba(OH)2溶液 |
0.06A |
0.09A |
0.11A |
②
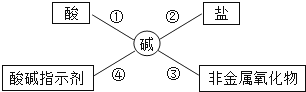
①Na2CO3; ②FeCl3; ③HCl; ④CO2


实验步骤如下:①组装好仪器并检查气密性。②通入一会儿空气③用托盘天平称量干燥管D的质量为m1;④称量纯碱样品的质量为n,装入广口瓶B内;⑤打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑥往试管人缓缓通入空气数分钟,然后称量干燥管D的质量为m2。
【提出问题】氢氧化钠是否完全变质?
【猜想与假设】①部分变质,固体是NaOH和Na2CO3的混合物;②全部变质,固体是。
【查阅资料】①Na2CO3溶液和FeCl3溶液会发生反应,有红褐色絮状沉淀等现象出现;
②NaCl溶液和BaCl2溶液均呈中性。
【进行实验】
|
步骤 |
实验操作 |
实验现象 |
|
1 |
取少量固体于小烧杯中,加水充分溶解 |
固体全部溶解 |
|
2 |
取少量烧杯中的溶液于试管中,加入过量的 BaCl2 溶液 |
产生白色沉淀 |
|
3 |
取于另一试管中,再加入少量 FeCl3 溶液 |
产生红褐色絮状沉淀 |
【解释与结论】
⑴请将步骤3实验操作补充完整1;
⑵步骤2加入过量BaCl2溶液的目的是;
⑶根据实验现象,可确定该固体是:NaOH和Na2CO3的混合物;
⑷【交流与评价】小科同学把步骤3中的FeCl3溶液改为无色酚酞溶液,若无色酚酞试液变红,也可以确定该固体的组成成分。你认为是否合理?;

请回答下列问题:

|
样品 |
第1份 |
第2份 |
第3份 |
第4份 |
第5份 |
|
取样品质量(g) |
40.0 |
40.0 |
40.0 |
40.0 |
40.0 |
|
取稀硫酸质量(g) |
30.0 |
60.0 |
90.0 |
120.0 |
150.0 |
|
产生气体质量(g) |
0.3 |
0.6 |
0.9 |
m |
1.0 |
按要求回答下列问题:

