选项 | 物质(括号内为杂质) | 除杂试剂 | 分离方法 |
A |
| 加热 | |
B | 饱和 | 洗气 | |
C | 盐酸 | 过滤 | |
D | 饱和食盐水 | 洗气 |
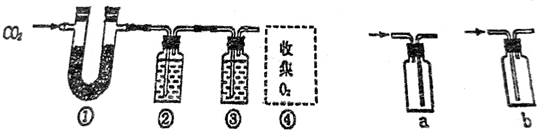
A | B | C | D |
|
|
|
|
烧杯 | 酒精灯 | 坩埚 | 漏斗 |
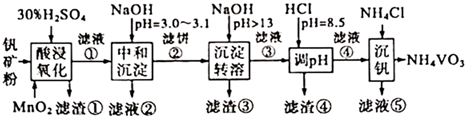
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | | | | | |
| 开始沉淀pH | 1.9 | 7.0 | 8.9 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 10.9 | 4.7 | 10.1 |
下列说法错误的是( )
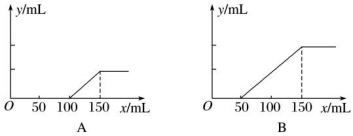
在 A 情况下,溶质是(填化学式) ,其物质的量之比为。

①Na2SO3的电离方程式是。
②下列反应中,能用同一离子方程式表示的是(填序号)。
A.Ca(OH)2溶液与稀CH3COOH B.NaOH和稀H2SO4
C.Ca(OH)2溶液与稀HNO3 D.NaOH和稀盐酸
③过程I的离子方程式是 。
④过程Ⅱ中反应的化学方程式是 。
⑤双碱法脱硫过程中,循环利用的物质是(填化学式)
该电池消耗6.6gCO2时,消耗标准状况下CO2的体积是 L,其中含氧原子个(已知阿伏加德罗常数的数值为NA)
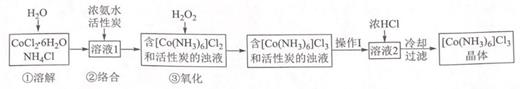
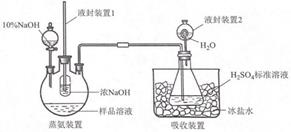
①蒸氨:取 m g 样品进行测定。添加药品后,加热三颈烧瓶,蒸出的 NH3 通入含有V1mLc1 mol•L﹣1H2SO4 标准溶液的锥形瓶中。
液封装置1的作用是
②滴定:将液封装置2中的水倒入锥形瓶后,滴定过剩的H2SO4 , 消耗V2mLC2mol•L﹣1的 NaOH 的标准液产品中 NH3 的质量分数为若未将液封装置 2 中的水倒入锥形瓶,测得 NH3 的质量分数可能(填“偏高”或“偏低”)。
①滴定终点的判断:当滴入最后一滴标准液,溶液恰好(填颜色变化),且半分钟不再发生变化。
②废铜屑中铜的百分含量为。
|
84消毒液 (有效成分)NaClO (规格)1000 mL (质量分数)25% (密度)1.20g/cm3 |
回答下列问题:
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水