C→CO-→CO2→H2CO3→CaCO3→CaO

已知:Ⅰ、粗品硫酸钠含少量H2SO4、MgSO4、CaSO4、FeSO4等杂质。
Ⅱ、在溶液里,微溶物发生复分解反应可转化为不溶物。
Ⅲ、部分物质的溶解性见表。
部分物质的溶解性表(室温)
阴离子 阳离子 | ||
Na+ | 溶 | 溶 |
Ca2+ | 微溶 | 不溶 |
Mg2+ | 溶 | 微溶 |
Fe2+ | 溶 | 不溶 |

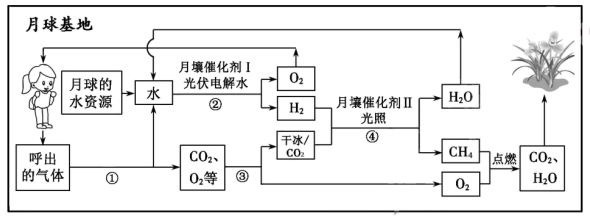

①在氧气生成系统中,运用电解水的方法制氧气,反应的化学方程式是。
②该流程中,理论上进入氧气生成系统发生电解的水与萨巴蒂尔反应系统中生成的水质量比是。

已知:①CeO2不溶于稀硫酸,也不溶于NaOH溶液;②SiO2不溶于酸(氢氟酸除外)。
回答下列问题:


(相对分子质量:KNO3-101 NaCl-58.5 AgNO3-170 AgCl-143.5)
②分离出的浓盐水是(填“纯净物”或“混合物”)。
③该方法除了用于海水淡化,还可用于。
A.硬水软化 B.污水处理 C.物质鉴别
国家规定居民生活用水中盐类物质总含量≤500mg·L-1 , 计算并推断所得淡水中盐类总含量生活用水的标准(填“达到”或“未达到”);该工厂一套淡化装置每小时产生浓盐水300L,其中含有NaClkg。
| 氯化钠 | 氯化镁 | 硫酸镁 | 硫酸钙 |
淡水 | 0.17 | 0.012 | 4.8×10-4 | 8.5×10-4 |
浓盐水 | 45.0 | 3.6 | 3.3 | 0.14 |

①写出生成Mg(OH)2的反应方程式。
②浓盐水经过步骤1和2两步反应后又获得了MgCl2 , 设计这两步的目的是。
③图中未涉及的反应类型为。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
④镁在空气中燃烧发出耀眼白光,依据此现象可用镁制作(写出一种即可)。
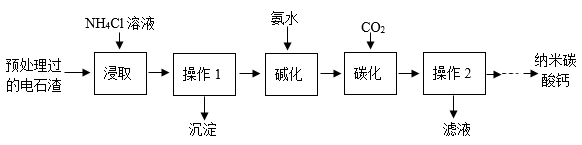
已知:①NH4Cl溶液显酸性;
②“浸取”时的主要反应为;
③“碳化”时的主要反应为。


温度 | 反应液浑浊所需时间(单位:秒) | 反应完全所需时间(单位:分钟) |
20℃ | 480 | >180 |
40℃ | 120 | 180 |
60℃ | 1 | 50 |
80℃ | 1 | 68 |
实际碳化反应的温度采用了60℃,温度不宜过高的原因可能是(写出一条即可)。

Ⅰ、制碱石灰的流程:
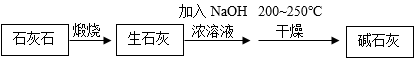
Ⅱ、Ca(OH)2的分解温度是580℃;NaOH受热不分解。
煅烧石灰石发生反应的化学方程式是。
【作出猜想】样品中的成分可能有下列几种:
猜想1:Ca(OH)2、NaOH
猜想2:CaCO3、Ca(OH)2、NaOH
猜想3:CaCO3、NaOH、Na2CO3
猜想4:CaCO3、Na2CO3
【实验探究】该小组同学设计并进行了如下实验(已知BaCl2溶液呈中性)。
|
实验步骤 |
现象 |
结论 |
|
①取5 g“碱石灰”样品于烧杯中,加入50 g水,充分搅拌后,静置 |
烧杯底部有白色固体 |
猜想1不正确 |
|
②取①烧杯中上层清液少许,加入试剂X |
无明显现象 |
猜想2不正确 |
|
③取①烧杯中上层清液少许,滴2滴酚酞溶液 |
溶液变红 |
猜想3正确,而猜想4不正确 |
|
④取③变红的溶液,加入过量BaCl2溶液 |
|
实验①方案不严密,理由是。
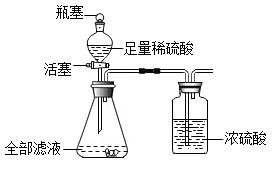
实验记录如下表。
|
滤渣质量 |
活塞关闭时整个装置总质量(仪器+药品) |
打开瓶塞和活塞反应完成后整个装置总质量(仪器+药品) |
|
8.00 g |
442.64g |
442.20g |
【结论与评价】
根据数据可计算原样品中各成分的含量,其中NaOH的质量分数是。