CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ•mol-1
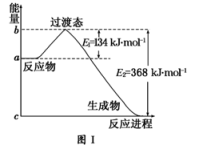
C . 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 D . 已知热化学方程式:SO2(g)+反应I:V2O5(s)+SO2(g)![]() V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
V2O4(s)+SO3(g) ΔH1=+24 kJ·mol-1
反应II:2V2O4(s)+O2(g)![]() 2V2O5(s) ΔH2=-246 kJ·mol-1
2V2O5(s) ΔH2=-246 kJ·mol-1
反应中的能量变化如图,下列说法不正确的是( )

| 共价键 | H- H | H-O |
| 键能/(kJ·mol-1) | 436 | 463 |
| 热化学方程式 | 2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1 | |
则2O(g)=O2(g)的ΔH为( )
[Cu(NH3)2]++CO+NH3[Cu(NH3)3CO]+ ΔH<0。下列说法错误的是( )
| t/s | 0 | 50 | 100 | 150 |
| n(X2O5)mol | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是:( )
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 800 | 800 | 850 |
达到平衡时间/min | 40 | 10 | 30 |
平衡时c(D)/(mol·L-1) | 0.5 | 0.5 | 0.15 |
反应的能量变化 | Q1 | Q2 | Q3 |
v(D) = 0.05mol ·L-1 ·min-1
D . 由表中信息可知: Q1=Q2<Q3a.沿玻璃棒缓慢倒入 b.分三次倒入 c.一次迅速倒入
②3FeO(s)+H2O(g) Fe3O4(s)+H2(g) ΔH2= -57.2 kJ·mol-1
③C(s)+CO2(g) 2CO(g) ΔH3=+172.4 kJ·mol-1
碳与水蒸气反应制氢气的总反应热化学方程式是 。

①图像中T2和T1的关系是:T1T2(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是:。
③ 合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是 。
①20min后,反应达平衡,氨气的浓度为0.3 mol·L -1 , 用N2表示的平均反应速率为mol/(L·min)。且此时,混合气体的总压强为p,则该反应的化学平衡常数Kp= [对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入1.8mol N2和4.2mol H2 , 再次达平衡后,氨气的浓度0.6 mol·L -1(填“大于”或“小于”或“等于”)。
滴定管是酸碱中和滴定中重要的仪器,向25 mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为0.00 mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为(填“大于”“小于”或“等于”)25.00 mL。
实验步骤:称取1.0g粗品配制250 mL溶液待用。
用碱式滴定管取25.00 mL 待测液锥形瓶中。
用浓度为0.1000mol•L-1的KMnO4酸性标准溶液进行滴定
回答下列问题:
配制待测液需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、;
|
滴定次数 |
待测液的体积/mL |
0.1000mol•L-1KMnO4的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
第一次 |
25.00 |
0.50 |
20.60 |
|
第二次 |
25.00 |
6.00 |
25.90 |
|
第三次 |
25.00 |
1.40 |
24.20 |
依据上表数据计算粗品中Na2SO3的质量分数为。

其中符合溶液的pH随温度变化的曲线是(填罗马数字),
溶液的pH随温度变化的原因是。

①试分析图中a、b、c、d四个点,水的电离程度最大的是点。
②在b点,溶液中各离子浓度由大到小的排列顺序是。
③由b到c发生反应的离子方程式为。