 B . 节日烟花呈现了金属元素的焰色
B . 节日烟花呈现了金属元素的焰色 C . 焙制糕点时常用碳酸钠作膨松剂
C . 焙制糕点时常用碳酸钠作膨松剂 D . 漂粉精可用于游泳池消毒
D . 漂粉精可用于游泳池消毒
①向X中加入少量氯水,再滴加淀粉溶液,未显蓝色;
②另取100 mL X加入过量氯水,再滴加足量BaCl2(aq),得到沉淀6.99 g;
③将②反应后的混合液过滤,在滤液中加足量NaOH(aq)加热,生成0.01 mol气体。
根据上述实验,原溶液中( )



下列说法不正确的是( )

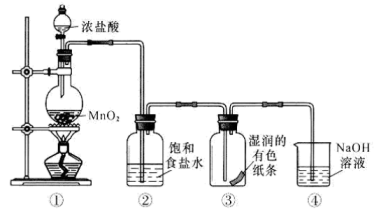
①装置A中盛装浓盐酸的仪器名称是。
②实验开始前应先进行的操作是。
③装置B中的试剂是。
④装置C中浓硫酸的作用是。
⑤装置A中圆底烧瓶内发生反应的化学方程式为。
⑥为防止氯气污染空气,装置E中应选用的试剂为,该反应的离子方程式为。
⑦室温下,氯气的密度为2.91g/L,若需制取710mL氯气,则理论上需要消耗MnO2固体的质量为g(保留到小数点后一位)。


①需要用量筒量取mL上述浓硫酸进行配制。
②为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是、。
③在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少液体溅出
f.未洗涤稀释浓硫酸的烧杯

①B与CO2反应:。
②A与E作用生成D:。