 B . 倾倒液体
B . 倾倒液体 C . 加热液体
C . 加热液体 D . 取固体粉末
D . 取固体粉末



 B . 火锅
B . 火锅 C . 耐酸阀门
C . 耐酸阀门 D . 乐器
D . 乐器
实验目的 | 实验操作 | |
A | 鉴别生石灰和熟石灰 | 取样,加入少量水 |
B | 鉴别二氧化碳和氮气两瓶气体 | 将燃着的木条分别伸入集气瓶中 |
C | 除去氯化钠固体中少量碳酸钠 | 加入过量稀硫酸 |
D | 除去氧气中的水蒸气 | 通过过量稀硫酸 |


A 硝酸钾溶液的溶质是。 | B 碳酸钙的主要用途是(写1条即可)。 |
营养成分表 | |
项目 | 每100 mL |
能量 | 280 kJ |
蛋白质 | 3.2 g |
脂肪 | 3.8 g |
碳水化合物 | 5.0 g |
钠 | 53 mg |
钙 | 100 mg |

《中国气候变化蓝皮书(2022)》指出,全球变暖趋势仍在继续。减少CO2排放,实现碳中和迫在眉睫。
碳循环是实现碳中和的重要途径之一,研究人员提出通过促进人为碳循环实现碳中和的方法,如图1。首先,将太阳能转化为电能,用于电解水制得氢气,像这样利用可再生能源制得的氢气称为绿色氢气。然后,在催化剂的作用下,将捕捉的CO2与氢气反应制得甲醇(CH3OH)等化工产品。
开发高效、稳定的催化剂对实现上述人为碳循环至关重要。研究人员使用两种催化剂,探究了影响CO2与H2制备甲醇反应效果的因素。反应效果可用甲醇的选择性衡量,数值越大反应效果越好,结果如图2。


实现碳中和人人有责,让我们从日常点滴做起,低碳生活。
依据文章内容回答下列问题。
Ⅰ、①⑤⑨组实验的目的是。
II、制备甲醇反应效果与温度的关系是。
Ⅲ、实验研究的多个因素中,对反应效果影响最大的是。



实验1 配制40 g 5%的过氧化氢溶液 | 实验2 验证可燃物燃烧条件 |
可供选择的仪器: |
|
①H2O2溶液与MnO2接触,反应的化学方程式为。
②能证明可燃物燃烧需要与氧气接触的实验现象是。

Ⅰ、④中反应的化学方程式为。
Ⅱ、①中有气泡产生。下列实验组合中,能得出镍、铜、银的金属活动性顺序的有(填序号)。
A.①③④ B.①②③ C.①④ D.②④
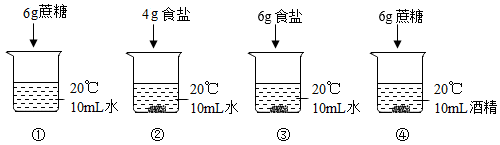
Ⅰ、对比①和④可得到的结论是。
Ⅱ、能比较出食盐和蔗糖溶解性强弱的实验组有(填序号,写全对比组)。

Ⅰ、为证明CO2与NaOH发生反应补充了实验⑥,观察到⑥中气球变鼓的程度小于⑤。⑥中集气瓶里应加入。
Ⅱ、写出CO2与NaOH发生反应的化学方程式。
【查阅资料】
①抗酸药主要利用有效成分与胃液中的过量盐酸反应,药品用量一般为1~2片(约0.5 g~1 g)。
②氧化镁和氧化铁均属于金属氧化物,与盐酸反应的原理相似。
③胃蛋白酶是胃中唯一的消化性蛋白酶,当pH为3~5时活性较好,当pH超过6时,因变性而失去活性。
④理想抗酸药应具备起效快速,避免产生气体刺激溃疡面等特点。
【进行实验】
I、是否引起胃内压强的变化
锥形瓶中模拟胃酸过多的环境。将气球中的抗酸药加入锥形瓶中、
装置及药品 | 序号 | 抗酸药 | 现象 |
| 1-1 | 氢氧化铝片 | 气球无明显变化 |
1-2 | 碳酸氢钠片 | 气球明显膨胀 | |
1-3 | 铝碳酸镁咀嚼片 | 气球无明显变化 | |
1-4 | 氧化镁粉末 | 气球无明显变化 |
II、是否引起胃内温度和pH的变化
利用图1进行实验。向4个烧瓶中分别加入抗酸药,打开恒压滴液漏斗,滴加0.37%的足量稀盐酸。传感器测得的相关结果见图2、3、4。




【解释与结论】
查阅资料发现I中实验1-3无明显现象是与物质的用量有关。小明同学设计实验证明了铝碳酸镁咀嚼片中含有碳酸根离子,实验操作和现象:取6片铝碳酸镁咀嚼片于试管中,。