
实验操作 | 现象 | 结论 | |
A | 向 | 先变橙色,后变蓝色 | 氧化性: |
B | 向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的 | 无砖红色沉淀 | 蔗糖未发生水解 |
C | 石蜡油加强热,将产生的气体通入 | 溶液红棕色变无色 | 气体中含有不饱和烃 |
D | 加热试管中的聚氯乙烯薄膜碎片 | 试管口润湿的蓝色石蕊试纸变红 | 氯乙烯加聚是可逆反应 |
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出.离心分离.
③取②的上层清液,向其中滴加溶液有沉淀生成.
该样品中确定存在的是( )
目的 | 方案设计 | 现象和结论 | |
A | 检验硫酸厂周边空气中是否含有二氧化硫 | 用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,观察溶液颜色变化 | 溶液不变色,说明空气中不含二氧化硫 |
B | 鉴定某涂改液中是否存在含氯化合物 | 取涂改液与KOH溶液混合加热充分反应,取上层清液,硝酸酸化,加入硝酸银溶液,观察现象 | 出现白色沉淀,说明涂改液中存在含氯化合物 |
C | 检验牙膏中是否含有甘油 | 将适量牙膏样品与蒸馏水混合,搅拌,静置一段时间,取上层清液,加入新制的Cu(OH)2 , 振荡,观察现象 | 溶液出现绛蓝色,说明牙膏中含有甘油 |
D | 鉴别食盐与亚硝酸钠 | 各取少量固体加水溶解,分别滴加含淀粉的KI溶液,振荡,观察溶液颜色变化 | 溶液变蓝色的为亚硝酸钠;溶液不变蓝的为食盐 |
 B .
B . 
下列说法正确的的是( )
| 实验操作 | 实验现象 | |
| A. | 将盛有Fe(OH)3胶体的烧杯置于暗处,用红色激光笔照射烧杯中的液体 | 在与光束垂直的方向看到一条光亮的“通路” |
| B. | 向盛有少量Mg(OH)2沉淀的试管中加入适量饱和NH4Cl溶液,振荡 | 白色沉淀溶解 |
| C. | 向盛有3.0mL无水乙醇的试管中加入一小块金属钠 | 有气泡产生 |
| D. | 向盛有2.0mL甲苯的试管中加入3滴酸性KMnO4 , 溶液,用力振荡 | 紫色不变 |
| 实验操作 | 现象 | 结论 | |
| A | 向KBr、KI混合溶液中依次加入少量氯水和CCl4 , 振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性: |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| C | 用pH计测定pH:①NaHCO3溶液②CH3COONa溶液 | pH:①>② | H2CO3酸性弱于CH3COOH |
| D | 把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口 | 木条复燃 | 反应生成了O2 |

| 气体 | 试剂 | 制备装置 | 收集方法 | |
| A | O2 | KMnO4 | a | d |
| B | H2 | Zn+稀H2SO4 | b | e |
| C | NO | Cu+稀HNO3 | b | c |
| D | CO2 | CaCO3+稀H2SO4 | b | c |

| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和FeCl3溶液 |
| C | 测定NaOH溶液浓度 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测NaOH溶液、已知浓度的盐酸、甲基橙试剂 |
| D | 制备乙酸乙酯 | 试管、量筒、导管、酒精灯 | 冰醋酸、无水乙醇、饱和Na2CO3溶液 |
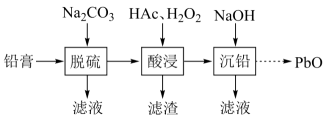
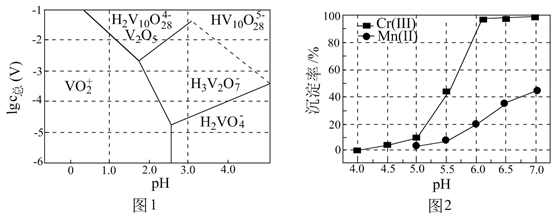
一些难溶电解质的溶度积常数如下表:
难溶电解质 | ||||
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物 | ||||
开始沉淀的 | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的 | 3.2 | 8.3 | 4.6 | 9.1 |
回答下列问题:
(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属
在醋酸中转化为
, 其化学方程式为;
(ⅲ)也能使
转化为
,
的作用是。
Ⅰ.取已知浓度的溶液,搅拌下滴加足量
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量
固体,制得
和
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
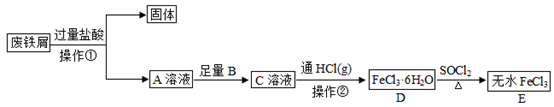
回答下列问题:



已知:①无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯。
②制备无水二氯化锰的主要反应:(CH3COO)2Mn+CH3COClMnCl2↓+2(CH3COO)2O。
③乙酰氯遇水发生反应:CH3COCl+H2O→CH3COOH+HCl。
请回答:
纯化完成→( )→( )→( )→( )→将产品转至干燥器中保存
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图2装置中U形管内NaOH固体的作用是。
(已知:Ga3++4OH- [Ga(OH)4]- K′=
≈1.0×1034)

相关性质如表:
| 物质 | 熔点 | 沸点 | 性质 |
| SbCl3 | 73.4℃ | 220.3℃ | 极易水解 |
| SbCl5 | 3.5℃ | 140℃分解79℃/2.9kPa | 极易水解 |
回答下列问题:
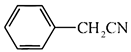 和必要的无机试剂为原料,合成
和必要的无机试剂为原料,合成  ,在方框中写出路线流程图。
,在方框中写出路线流程图。 
该小组同学设计了如下气体发生装置(夹持装置省略)

甲装置中主要仪器的名称为。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
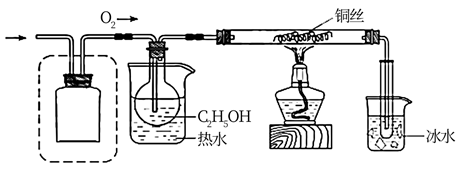
在图中方框内补全干燥装置和干燥剂。
为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
|
实验序号 |
检验试剂和反应条件 |
现象 |
结论 |
|
① |
酸性KMnO4溶液 |
紫红色褪去 |
产物含有乙醛 |
|
② |
新制Cu(OH)2 , 加热 |
生成砖红色沉淀 |
产物含有乙醛 |
|
③ |
微红色含酚酞的NaOH溶液 |
微红色褪去 |
产物可能含有乙酸 |
实验①~③中的结论不合理的是(填序号),原因是。
①称取 ,配成
溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以
的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
可供选择的试剂: 、
、
、
、饱和
、饱和
可供选择的发生装置(净化装置略去):
已知:氯化亚砜( ![]() )熔点-101℃,沸点76℃,易水解。
)熔点-101℃,沸点76℃,易水解。
回答问题:
②结合电极反应式说明生成溶液a的原理。
电解效率η和选择性S的定义:
η(B)= ×100%
S(B)= ×100%
①若η(EO)=100%,则溶液b的溶质为。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:
I.阳极有H2O放电
II.阳极有乙烯放电
III.阳极室流出液中含有Cl2和HClO
……
i.检验电解产物,推测I不成立。需要检验的物质是。
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2 , η(CO2)≈%。经检验阳极放电产物没有CO2。
iii.实验证实推测III成立,所用试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。
实验I:将0.0100 mol/L Ag2SO4溶液与0.0400 mo/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II:向少量Ag粉中加入0.0100 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实沉淀为Ag。现象是。
②II中溶液选用Fe2(SO4)3 , 不选用Fe(NO3)3的原因是。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag”为可逆反应。
③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及现象。

实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol/L KSCN标准溶液滴定Ag+ , 至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
Fe3++SCN- FeSCN2+(红色) K=102.3
①滴定过程中Fe3+的作用是。
②测得平衡常数K=。
①取实验I的浊液测定c(Ag+),会使所测K值(填“偏高”“偏低”或“不受影响”)。
②不用实验II中清液测定K的原因是。
![]() 资料:
资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2·xH2O↓+H2SO4
iii.0.1 mol/L Fe2+生成Fe(OH)2 , 开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1 mol/L Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
①加入过量铁粉的目的是。
②充分反应后,分离混合物的方法是。
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。

①产生白色沉淀的离子方程式是。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+)0.1mol/L(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:。
铁黄纯度可以通过产品的耗酸量确定。
wg铁黄 溶液b
溶液c
滴定
资料:Fe3++3 =Fe(C2O4)
,Fe(C2O4)
不与稀碱液反应
Na2C2O4过量,会使测定结果(填“偏大”“偏小”或“不受影响”)
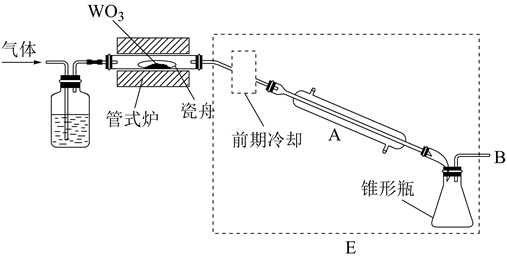
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4 , 通过IO 离子交换柱发生反应:WO
+Ba(IO3)2=BaWO4+2IO
;交换结束后,向所得含IO
的溶液中加入适量酸化的KI溶液,发生反应:IO
+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O
=2I-+S4O
。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将(填“偏大”“偏小”或“不变”)。


中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。
