①用少量蒸馏水洗涤烧杯内壁和玻璃棒 2-3 次,洗涤液均注入容量瓶,振荡
②在盛有 NaOH 固体的烧杯中加入适量水溶解
③将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
④将容量瓶盖紧,反复上下颠倒,摇匀
⑤改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑥继续往容量瓶内小心加水,直到液面接近刻度线 1-2cm 处
①定容 ②转移 ③量取 ④洗涤 ⑤稀释 ⑥摇匀
正确的操作顺序应是___________。
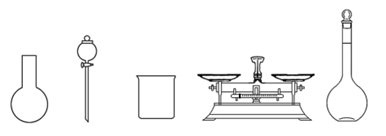
①如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。

②该实验中需要量取8mol•L-1的H2SO4溶液mL。
属于电解质的是,属于非电解质的是能导电的是 。

其中I为化合反应,IV是反应。

①Na2SO3的电离方程式是。
②下列反应中,能用同一离子方程式表示的是(填序号)。
A.Ca(OH)2溶液与稀CH3COOH B.NaOH和稀H2SO4
C.Ca(OH)2溶液与稀HNO3 D.NaOH和稀盐酸
③过程I的离子方程式是 。
④过程Ⅱ中反应的化学方程式是 。
⑤双碱法脱硫过程中,循环利用的物质是(填化学式)
该电池消耗6.6gCO2时,消耗标准状况下CO2的体积是 L,其中含氧原子个(已知阿伏加德罗常数的数值为NA)
|
84消毒液 (有效成分)NaClO (规格)1000 mL (质量分数)25% (密度)1.20g/cm3 |
回答下列问题:
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水
|
84消毒液 [有效成分] NaClO [规格] 3.8L [质量分数] 28% [密度] 1.20g·cm-3 |
①配制240 mL 0.1 mol·L-1的盐酸应选用mL的容量瓶。
②下列操作对应所配溶液的浓度偏大的是。
A.定容时,俯视刻度线;
B.用量筒量取浓盐酸时,仰视刻度线;
C.定容摇匀后发现溶液凹面低于刻度线,加水至刻度线;
D.容量瓶在使用前未干燥,里面有少量蒸馏水。
③与洁厕灵(浓盐酸)不能混用的原因(用离子方程式表述):。
