




序号 | a | b | c | d |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
当向装置D中缓缓通入少量氯气时,发生反应的离子方程式为;然后打开活塞,将装置D中少量溶液放入装置E中,发生反应的化学方程式为。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ | |||
4 | ⑦ |
请回答下列问题:
i.铷在元素周期表中的位置:第周期、第族。
ii.关于铷的下列说法中错误的是(填字母序号)。
a.与水反应比钠更剧烈 b.熔沸点高于钠 c.原子半径大于钾 d.金属性弱于钾
①使氯水呈现黄绿色的是,②能使AgNO3溶液产生白色沉淀的是,③能使紫色石蕊试液显红色的是,④能使红色布条褪色的是。
a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵
g.烧杯 h.坩埚 i.石棉网 j.玻璃片 k.药匙 l.燃烧匙
①观察钾的切面.硬度:,颜色:
②预测钾的性质,并进行实验验证(用化学方程式表示):
在空气中缓慢氧化:;
点燃,发生剧烈燃烧:.
③结论:钾是一种活泼的金属单质,其化学性质比钠活泼.
④该小组研究钾的性质用到了哪几种方法?.

请回答下列问题:
①B中选用的试剂是饱和食盐水,其作用是;
②D中反应的化学方程式是;
③E中发生的反应的离子方程式是.
金属钠与水的反应是中学化学中的一个重要反应.在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:

A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
A.用铝箔包住钠
B.用锡箔包住钠
C.直接将钠投入水中

实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水试回答:
a.视线与凹液面最低数相平b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平d.读数时不一定使甲、乙管液面相平.
某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应.他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题.

写出装置A中发生反应的化学方程式: .
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以 在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2: ;假设3:既有Na2SO3 , 又有Na2SO4 .
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式: .
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4 , 该方案是否合理 (填“是”或“否”),理由是
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
实验步骤 | 现象 |
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
②向上试管中加入过量的 , 将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液 |
③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为: .
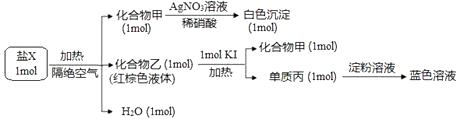

乙同学的实验原理是,
V分别取5mL 1mol/L NaBr溶液于两支小试管中
VI向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
VII向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
VIII…