




压强(Pa) 温度(℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
500 | 96.75% | 97.67% | 98.52% | 98.94% |
600 | 85.20% | 88.97% | 92.76% | 94.68% |
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)、;
②将尾气中SO2在一定条件下转化为CaSO4 , 然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式;
A.氨水 B.硫化氢气体
C.硫酸钠溶液 D.纯碱溶液
Ⅱ合成氨的流程示意图如下:

回答下列问题:
工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是,;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式,;
CO(g)+H2O(g)⇌CO2 (g)+H2 (g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于.

相关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
从结构上解释N2化学性质稳定的原因。上述固氮反应的化学方程式是。固氮的适宜温度范围是。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3 , 且产物MgCl2能直接循环利用,但NH3的收率较低,原因是。
活性炭还原NO2的原理为2NO2(g)+2C(s)N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2O4)。实验测得NO2的转化率与时间的关系如图所示:

a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变

步骤1:按图连接好实验装置,……………………….。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:

上述流程中能够实现氮的固定的是(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
①一定条件下,在体积10 L的密闭容器中进行,半分钟后,NO的物质的量增加了4.5 mol,则此反应的平均速率v(NH3)=mol·(L·s)-1;
②在相同温度下,向该容器中通入一定量的NH3气体,反应速率将(填“加快”“减慢”或“不变”)。
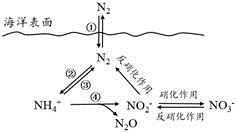
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
NH4++ 5O2=2NO2-+ H+++
|
温度/℃ |
样本氨氮含量/mg |
处理24 h |
处理48 h |
|
氨氮含量/mg |
氨氮含量/mg |
||
|
20 |
1008 |
838 |
788 |
|
25 |
1008 |
757 |
468 |
|
30 |
1008 |
798 |
600 |
|
40 |
1008 |
977 |
910 |
硝化细菌去除氨氮的最佳反应温度是,在最佳反应温度时,48 h内去除氨氮反应的平均速率是mg·L-1·h-1。

① 结合电极反应式简述间接氧化法去除氨氮的原理:。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将(填“增大”、“不变”或“减小”),请简述理由:。

由图可知合成氨反应 N2(g)+
H2(g)
NH3(g)的∆H= kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为。

①500℃时,反应平衡常数Kp(30MPa) Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为(保留2位有效数字),Kp=(MPa)-2(列出计算式)。

①阴极区生成NH3的电极方程式为。
②下列说法正确的是(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.该装置用金(Au)作催化剂目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
①从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为.
②如果按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为.
Ⅱ.某学习小组为了模拟工业上氨氧化制硝酸,用下列仪器进行实验:

C装置可以加热,回答下列问题:
工业上制取硝酸铵的流程图如下,请回答下列问题:

方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)上述三种方法中方法一最大的缺点是;方法三和方法二相比,优点是,缺点是。
 已知:25℃时,
已知:25℃时, 的
,
;
;
;该工艺中,
时,溶液中
元素以
的形态存在。
①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免
中混入
沉淀,溶液中
(列出算式)时,应停止加入
溶液。
②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量
,可析出
。

①该氧化物为。
②已知: 和
同族,
和
同族。在
与上层
的反应中,
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。

已知:NaCl、NH4HCO3、NaHCO3、NH4Cl四种盐在不同温度下的溶解度如下表所示:
温度溶解度(g) 物质 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
NaCl | 35.8 | 36.0 | 36.3. | 36.6 | 37.0 | 37.3 | 37.8 |
NH4HCO3 | 15.8. | 21.0 | 27.0 | 一 | 一 | — | — |
NaHCO3 | 8.15 | 9.6 | 11.1 | 12.7 | 14.45 | 。16.4 | 一 |
NH4Cl | 33.3 | 37.2 | 41.1 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。