



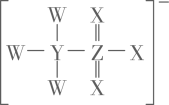


W | Q | ||
X | Y | Z |

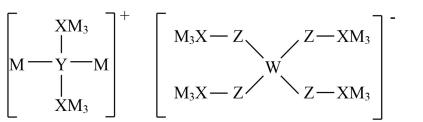


甲 | 乙 | ||
丙 | 丁 |
| 总压 | | | | |
| | 117 | 175 | x | 268 |
| | 167 | 161 | 167 | 167 |
| | 701 | 1087 | 1413 | 1605 |


|
坐标 原子 |
x |
y |
z |
|
Cd |
0 |
0 |
0 |
|
Sn |
0 |
0 |
0.5 |
|
As |
0.25 |
0.25 |
0.125 |

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。
已知: (
,白磷)=
(
,黑磷)
;
(
,白磷)=
(
,红磷)
;
由此推知,其中最稳定的磷单质是。
热稳定性:
(填“>”“<”)。
沸点:
(填“>”“<”),判断依据是。
a.不能与 反应 b.含离子键、共价键 c.能与水反应
②
③
达平衡时,体系中 ,
,
,则
℃时反应①的平衡常数
值为(用字母表示)。
A 离子键 B 配位键 C σ 键 D 范德华力


①根据上述事实推测原配合物中络离子化学式为。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式;生成气体分子的中心原子杂化方式为。

GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为。
③NH3 的VSEPR模型为 ;中心原子的杂化形式为,其杂化轨道的作用为。

①PH3分子中的中心原子的杂化方式是。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由:。

①则其化学式为。
②该晶体中距离Cu原子最近的Sn原子有个,这些Sn原子所呈现的构型为。
③若晶体密度为8.82g·cm-3 , 最近的Cu原子核间距为pm(用含NA的代数式表示)。