①
②
反应③的
, 平衡常数
(用
表示)。
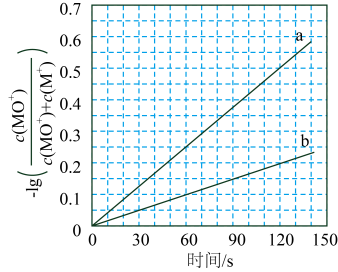

(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则与
反应的能量变化应为图中曲线(填“c”或“d”)。
(ⅲ)与
反应,氘代甲醇的产量
(填“>”“<”或“=”)。若
与
反应,生成的氘代甲醇有种。

①正反应的活化能为(用图中字母表示);
②当反应达平衡后,其他条件不变,升高温度,反应物的转化率将(填“增大”、“减小”、“不变”);
③B历程表明此反应采用的条件为(填标号)。
A.升高温度
B.降低温度
C.增大反应物浓度
D.使用催化剂

①CO(g)+2H2(g) CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①计算△H1=kJ.mol-1;
②已知△H3=+41.1 kJ.mol-1 , 则△H2 =kJ.mol-1。
①C+H2O(g) CO+H2;
②CO+H2O(g) CO2+H2;
H2(g)+1/2 O2(g)=H2O(g);ΔH=-285.8 kJ/mol;写出上述CO与H2O(g)反应的热化学方程式:
A.氢氧化钠溶液
B.氨水
C.石灰水或石灰乳
完成下列填空:
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
[CO2]/mol•L﹣1 | [H2]/mol•L﹣1 | [CH4]/mol•L﹣1 | [H2O]/mol•L﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为.
草酸:H2C2O4 , Ki1=5.9×10﹣2 , Ki2=6.4×10﹣5
0.1mol/LNa2CO3溶液的pH0.1mol/LNa2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是.若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是.(选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣] b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣] d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣]
2H2S(g) +3O2(g)=2SO2(g)+2H2O(g) ΔH1=akJ ·mol-1
H2S(g)+
SO2(g)=S2(g)+
H2O(g) ΔH2=b kJ ·mol-1
2H2S(g)+O2(g)=2S(g) +2H2O(g) ΔH3=c kJ ·mol-1
则2S(g)=S2(g) △H4= kJ ·mol-1

①图中表示H2S、H2变化的曲线分别是 、。反应达平衡的标志是(填标号)。
A.2v正(H2S)=4v逆(H2)
B.CH4的体积分数不再变化
C. 不再变化
D.混合气体的密度不再改变
②由图可知该反应的ΔH0(填“>”“<”或“=”),判断的理由是 。
③M点对应温度下,CH4的转化率为 ;950℃时该反应的Kp= ( MPa)2。

①曲线上m、n两点的正反应速率:(填“>”、“<”或“=”)
。
②T1时,若反应进行到时达到平衡,此时测得混合气体的总压强为
, 则
内,
, 反应平衡常数
(用分压表示,分压=物质的量分数×总压)。
③下列说法正确的是(填标号)。
A.当混合气体的密度不再随时间改变时,该反应达到平衡
B.该反应的反应物的键能总和小于生成物的键能总和
C.降低温度,有利于提高的转化率,反应平衡常数也增大
D.加入合适的催化剂,的值增大

①电池工作时,K电极上发生(填“还原反应”或“氧化反应”)。
②L电极上的电极反应式为。
③每消耗 , 电路中转移电子的物质的量为mol。
①科学上规定:在298.15K时,由最稳定的单质生成1mol某纯物质时的焓变,叫做该物质的标准摩尔生成焓();最稳定的单质的标准摩尔生成焓规定为零。已知:部分物质的标准摩尔生成焓数据如表(单位:
):
物质 | | | | | | |
| -46.1 | 0 | 90.3 | -241.8 | 33.2 | 11.1 |
则上述该反应的=。
②下列说法错误的是(填标号)。
a.当混合气体的平均摩尔质量不变时,反应达到平衡
b.当时,反应达到平衡
c.反应过程中分离出 , 正反应速率增大
d.平衡时,若的转化率为60%,则a=5

①前10min内用表示的平均化学反应速率为。
②反应②的为(分压=总压×物质的量分数)。
③甲同学绘制出如图所示平衡后四种气体在平衡体系中的体积分数随温度的变化情况。

乙同学认为曲线b不可能表示氢气的体积分数,原因是
Ⅰ.NONO*
Ⅱ.2NO*ON-NO*
Ⅲ.
Ⅳ.ON-NO-CO*ON-N*+CO2;
Ⅴ.。
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0 | 0.2 | 0.6 | 0.7 | 0.8 | 0.8 |
反应I:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1
化学键 | H-H | C | O-H | C=O |
键能/(kJ•mol-1) | 436 | 1071 | 464 | 803 |
②若K1、K2分别表示反应I、反应Ⅱ的平衡常数,则CO(g)+2H2(g)CH3OH(g)的平衡常数K=(用含K1、K2的代数式表示)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇

在特定催化剂条件下,其反应机理为
Ⅰ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+40.9kJ•mol-1
Ⅱ.CO(g)+2H2(g)=CH3OH(g) ΔH2
回答以下问题:

①有分子筛膜时甲醇产率高的原因是。
②某温度下,反应前后体系中某些物质的物质的量如表中数,则达到平衡时水蒸气的体积分数为;若该体系的总压强为p0 , 则反应Ⅱ的平衡常数Kp=(以平衡分压代替平衡浓度进行计算,分压=总压×物质的量分数)。
物质时刻 | n(CO2)/mol | n(H2)/mol | n(CO)/mol |
反应前 | 1 | 3 | 0 |
平衡时 | | | |

①压强p1p2(填“>”或“<”)。
②图中T1温度时,两条曲线几乎交于一点,试分析原因:。
Ⅰ.
Ⅱ.
研究发现,在反应Ⅰ、Ⅱ中,仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:

相同条件下,若反应起始时溶液中同时还含有盐酸,则图示点
中,
的浓度峰值点可能是(填标号)。与不同盐酸相比,
达浓度峰值时,
浓度(填“增大”“减小”或“不变”),
的反应(填“增大”“减小”或“不变”)。

①0~3min(保留两位小数)
②的平衡转化率是%
③平衡常数(保留两位小数)
| 实验编号 | 温度(K) | 催化剂 |
| 甲醇选择性(%) |
| A | 543 |
| 12.3 | 42.3 |
| B | 543 |
| 11.9 | 72.7 |
| C | 553 |
| 15.3 | 39.1 |
| D | 553 |
| 12.0 | 70.6 |
(注:甲醇选择性是指转化的中生成甲醇的百分含量),根据上表所给数据,用
生产甲醇的最优选项为(填字母)。
反应I:
反应Ⅱ:
反应Ⅲ:
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:


第1步,把光变成能量,目前采用光伏发电的形式;
第2步,电解水制氢气;
第3步,和
在催化剂等条件下合成
。
请回答下列问题:
①开始反应至时
的平均反应速率为
。
②该条件下,反应达到平衡时,的转化率为。

由图可知,三种不同催化剂催化性能由强到弱的顺序为。

通入气体的电极为极(填“正”或“负”);当电路通过
电子时,负极消耗物质的质量是g。