关于原溶液的说法正确的是( )
装置 | 实验 | 试剂a | 现象 |
| ① | 紫色石蕊溶液 | 溶液变红色 |
② |
| 产生白色沉淀 | |
③ | 稀硝酸溶液 | 溶液变黄色 | |
④ | 浓 | 产生具有刺激性气味的气体 |
下列离子方程式不能准确解释相应实验现象的是

已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是( )
① 用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
② 在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
③ 在第2份溶液中加入新制的氯水和CCl4 , 振荡后静置,下层溶液显橙红色。
则下列推断正确的是:( )
①取溶液少许滴加1~2滴紫色石蕊试液后溶液呈红色;
②取100 mL溶液,滴加1.0 mol/L的NaOH溶液至520 mL时恰好完全反应,加热后共收集到0.448 L(标准状况下)气体(假设气体全部逸出),同时产生沉淀。将沉淀过滤,洗涤,灼烧后得到一种黑色和白色的固体混合物,称得质量为14.0g。下图为滴加NaOH溶液过程图像(纵坐标为生成沉淀的质量,横坐标为滴加NaOH溶液体积)。继续向滤液中滴加足量的BaCl2溶液,又产生白色沉淀46.6 g;

③另取100mL原溶液通入标准状况下1.12LCl2 , 恰好完全反应,加入四氯化碳后,振荡静置后分层,下层呈现紫色(已知:Cl2+2I-=2Cl-+I2);
④在③中滴加硝酸酸化的硝酸银溶液后生成不溶于稀硝酸的白色沉淀。
结合以上实验现象和数据可知:
离子种类 |
| ||||||
离子浓度(mol/L) |
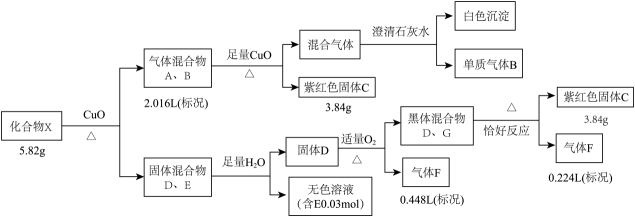
已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。



实验步骤:
步骤I
如图连接装置,检查装置气密性,装入试剂;
步骤II
旋开分液漏斗活塞与旋塞,并点燃酒精喷灯;
步骤III
足够长时间后,D中产生气泡速率变快时,停止加热,继续向烧瓶中滴水一段时间;
步骤IV
实验结束后,将D中所得溶液加水配制成250mL溶液;
请回答:

①用单线桥法表示电子转移过程:2KMnO4+10FeSO4+8H2SO4=2MnSO4+K2SO4+5Fe2(SO4)3+8H2O
②已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为。
①假设它按CaCO3受热分解的方式分解,反应的化学方程式为
②假设它按KClO3受热分解的方式分解,已知产物中有两种酸性氧化物生成,则分解反应的化学方程式为。