选项 | 劳动项目 | 化学知识 |
A | 传统工艺:手工制作陶瓷 | |
B | 学农活动:使用复合肥料培育植物 | 复合肥含N、P、K三种元素中的两种或三种 |
C | 自主探究:海带提碘 | 通过灼烧将有机碘转化为碘离子 |
D | 家务劳动:烹煮鱼时加入少量料酒和食醋可以去腥提鲜 | 食醋与料酒发生酯化反应,增加香味 |
![]()
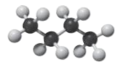 和
和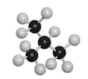 互为同分异构体,其沸点不同
D .
互为同分异构体,其沸点不同
D . 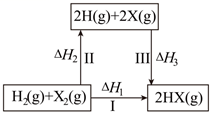
物质 用途 A.过氧化钠——a. 作供氧剂 B.液氨 b. 作制冷剂 C.浓硫酸 c. 作医用消毒剂 D.酒精 d. 作干燥剂 |

①检验F中已充满大量A中气体的方法:;
②D的作用是干燥气体,D中盛的是(写名称);



①可用来验证SO2具有漂白性的现象是:。
②从元素化合价的角度分析,SO2的性质:
a、当通入SO2一段时间后,可观察C中溶液褪色,说明SO2具有性。
b、如要验证SO2还具有另一方面的性质,D装置中的药品应为。
A.FeCl3溶液 B.氯水 C.氢硫酸 D.浓硝酸
若用图甲装置进行排空气法收集 , 气体应从(填“m”或“n”)口进入。

利用如图所示装置,进行还原
的反应。

已知:与
反应生成
和无毒气体
, 且
不能被浓硫酸和碱石灰吸收。
采用装置作为制取
的发生装置,写出该装置中发生反应的化学方程式:。

D+G→H;
F+J→B+C+I;
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥

①仪器A的名称是,A中发生反应的离子方程式是。
②验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,振荡、静置,可观察到。
③第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下,。

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是。
②过程III实验的目的是。
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,得电子能力逐渐减弱。
物质 用途 A.二氧化氯 a.蚀刻铜板 B.氯化铁 b.焙制糕点 C.碳酸氢钠 c.自来水消毒 |