A.白瓷马蹬壶 | B.东汉青铜奔马 | C.液晶显示屏 | D.西夏文佛经纸本 |
|
|
|
|


①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖和硫酸钡均属于电解质
④盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1~100nm
周期 | 族 | ||||||
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
1 | H | ||||||
2 | C | N | O | ||||
3 | Na | Al | Si | ||||
4 | K | Ca | |||||
分子筛中含有O和Al结合而成的Al2O3可以和下面的哪些物质反应?( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向某溶液中滴加几滴KSCN溶液 | 溶液变红 | 溶液中不可能含Fe2+ |
| B | 将铝箔置于火焰上灼烧 | 铝箔胀大并有熔融物滴落 | 铝箔灼烧生成氧化铝 |
| C | 将几滴饱和FeCl3溶液滴入一烧杯的沸水中,继续煮沸至溶液呈红褐色,停止加热 | 用激光笔照射烧杯中的液体,看到一条光亮的“通路” | 生成了Fe(OH)3胶体 |
| D | 向新制氯水中滴加几滴紫色石蕊试液 | 溶液先变红后褪色 | 新制氯水具有酸性和强氧化性 |
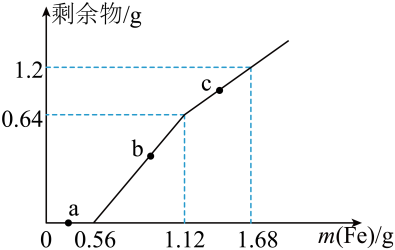
a.电解法 b.热还原法 c.热分解法 d.物理方法
现有气体,其质量是,在标况下的体积是,所含HCl分子的数目是,若将这
气体完全溶于水配成
溶液,所得盐酸的物质的量浓度为。
用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和。
①称取一定质量的固体,放入烧杯中,用适量蒸馏水稀释;
②向容量瓶中加水至液面离容量瓶刻度线下 , 改用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复翻转,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。


请回答下列问题:
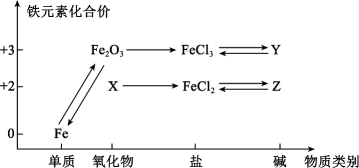
整套实验装置的连接顺序是(各接口处的字母代号);Ⅱ、如下图所示,此装置可用来制取和观察在空气中被氧化的颜色变化。实验时必须使用铁屑和
的硫酸,其他试剂任选。填写下列空白:


①与Cu反应的离子方程式为。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
ⅰ.CuSCN是难溶于水的白色固体;ⅱ.SCN的化学性质与相似;ⅲ.
填写实验方案:
| 实验方案 | 现象 |
| 步骤1:取4mL0.2mol/L的 | 无明显现象 |
| 步骤2:取4mL_▲_mol/L的 | 产生白色沉淀 |
步骤2中的溶液的浓度是mol/L,
与
反应的离子方程式为。