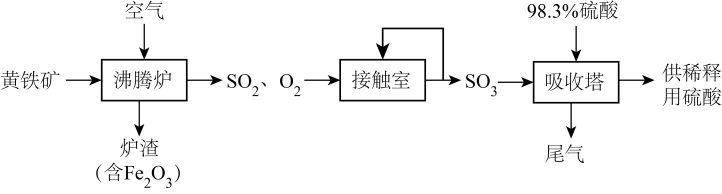
实验编号 | 温度/℃ | 起始量/ | 平衡量/ | 达到平衡所需时间/ | ||
1 | 4 | 2 | x | 0.8 | 6 | |
2 | 4 | 2 | 0.4 | 0.2 | t | |
下列说法错误的是( )
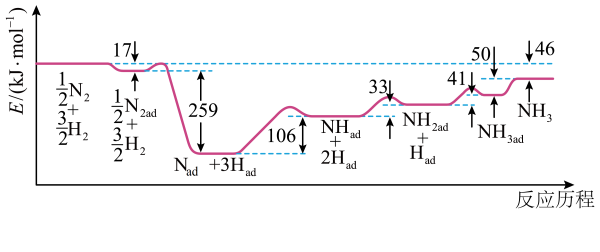
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
不同配比随温度变化对出口合成气中
的影响如图所示。

下列说法正确的是( )
第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是( )。
a.NH3+H2O+CO2=NH4HCO3 b.2NH3+CO2H2O+CO(NH2)2
上述两个反应所涉及的化合物中,属于离子化合物的是。
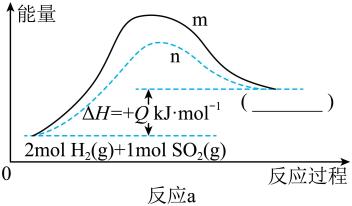
①曲线(填“m”或“n”)表示的是有催化剂参与反应的过程。
②图中括号内应该填写。
向恒温恒容密闭容器中充入一定量的CO和 , 发生反应b。下列描述可判断该反应达到平衡状态的是____。
①0~tmin内,
②该温度下,反应b的平衡常数
该方法的部分反应过程如图所示。下列说法合理的是____。
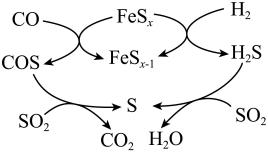
反应原理:
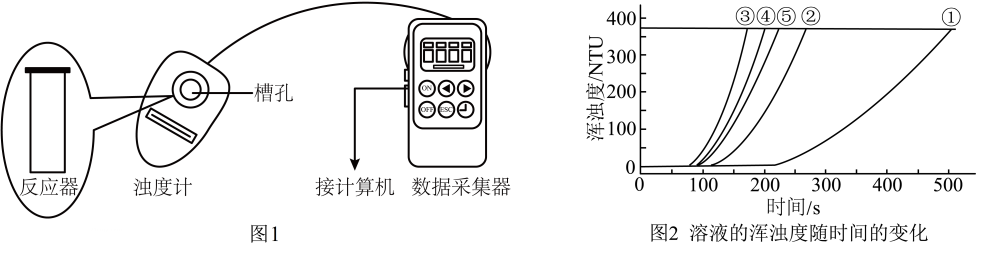
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。
实验编号 | | | 蒸馏水 | ||
| V/mL | | V/mL | V/mL | |
① | 0.1 | 1.5 | 0.1 | V1 | 10 |
② | 0.1 | 2.5 | 0.1 | V2 | 9 |
③ | 0.1 | 3.5 | 0.1 | 3.5 | 8 |
④ | 0.1 | V3 | 0.1 | 2.5 | 9 |
⑤ | 0.1 | V4 | 0.1 | 1.5 | 10 |
结论1:其它条件相同时,浓度越大,反应速率越大;
①结论2:;
②结论3:其它条件相同时,浓度改变对反应速率的影响程度大于
浓度改变对反应速率的影响程度。证据是。
主反应:(i-C4H10)(g)(i-C4H8)(g)+H2(g) △H1
副反应:(i-C4H10)(g)C3H6(g)+CH4(g) △H2>0

△H10(填“>”或“<”),p1p2(填“>”或“<”)。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
反应Ⅲ的 , 已知其正反应活化能为
, 则其逆反应活化能
;

总反应的化学方程式为;

①图1中,反应至a点的二氧化碳平均反应速率为;
②图1中,反应至c点 (填“大于”“小于”或“等于”),原因是,c点的
对应的是图2中的点。(已知
, k为速率常数,AR为常数,Ea为活化能,T为温度)
①下列能够说明反应Ⅲ在某种条件下已达到化学平衡状态的是(填标号)。
A. B.混合气体的密度不再变化
C.200℃时,容器内气体总压强不再变化
D.混合气体的平均相对分子质量不再变化

②使用催化剂乙,温度高于350℃时,转化率降低,原因可能是。
③研究表明该反应速率 , 其中
为速率常数,与温度、活化能有关。
℃的初始速率为
, 当
转化率为50%时,反应速率为
, 由此可知
。

①物质的量分数为75%的和25%的
所对应的曲线是(填“a”或“b”)。
②点时,
的转化率为。
点对应温度下,反应的压强平衡常数
(用平衡分压代替平衡浓度,分压=总压×物质的量分数。保留两位有效数字)。