a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
维生素C,又称抗坏血酸,化学式为C6H8O6 , 是一种水溶性的有机化合物。
维生素C具有酸性,在酸性环境中稳定,遇氧气、热、光、碱性物质,特别是有氧化酶及痕量Cu2+、Fe3+等金属离子存在时,可促进其被氧化而破坏。人类不能自身合成维生素C,必须通过食物、药物等摄取,其广泛的食物来源为各类新鲜蔬果。
维生素C具有重要的生理功能,人体缺乏维生素C易引发坏血病、牙龈出血等。维生素C是一种常见的抗氧化剂,能够防止自由基对人体的伤害,从而增强人体抵抗力、延缓衰老等。此外维生素C还可以使Fe元素从+3价转化为+2价,提高肝脏对铁的利用率,从而治疗缺铁性贫血。若短期内服用过量的维生素C,会产生多尿、皮疹等副作用,长期服用过量的维生素C,可能导致草酸及尿酸结石。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
①通入HCl气体 ②加入Na2CO3固体 ③加入NaOH固体 ④加热
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
“浸锰”过程中,发生反应
, 则可推断:
填“
”或“
”
。
在
溶液中,银锰精矿中的
和氧化锰矿中的
发生反应,则浸锰液中主要的金属阳离子有。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中
的作用:。
该步反应的离子方程式有。
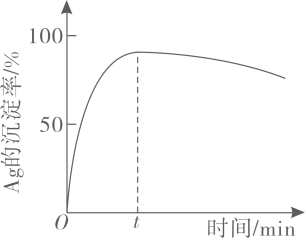
一定温度下,
的沉淀率随反应时间的变化如图所示。解释
分钟后
的沉淀率逐渐减小的原因:。
实验记录如下:
|
|
实验现象 |
|
|
实验Ⅰ |
|
极少量 |
|
实验Ⅱ |
|
部分 |
|
实验Ⅲ |
|
|
初始阶段,
被氧化的反应速率:实验Ⅰ
填“
”“
”或“
”
实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
蓝色
或
无色
, 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入
, 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤
的目的是。
查阅资料,
,
无色
容易被空气氧化。用离子方程式解释步骤
的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
, 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓
溶液,
填实验现象
, 观察到少量红色的铜。分析铜未完全反应的原因是。

II.水解制备偏钛酸:浸出液中含Fe3+、Ti4+等,先向其中加入还原铁粉,然后控制水解条件实现Ti4+水解制备偏钛酸。

备注:还原铁粉添加比=;n铁粉为还原铁粉添加量,n理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量。


电极X连接电源(填“正”或“负”)极。

②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中=。[已知Ksp(CaCO3)=2.8×10-9 , Ksp(FeCO3)=2×10-11]



X的化学式为。

已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
①下列有关CO的说法正确的是(填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为,该反应中氧化剂与还原剂的质量之比为。
③每转移0.2mol电子,同时生成CO的体积为(标准状况下)。
①氩气的作用为。
②该反应的基本反应类型为。
①上述反应的离子方程式为。
②金属钛的质量分数为(用含m、c、V的代数式表示)。

已知:在350℃以上会分解生成
和
。
在焙烧过程中生成
、
。锡(Sn)位于第五周期第ⅣA族。

![]()
反应Ⅰ:2NH3(l) +
CO2(g) NH2COONH4(l) Δ H1 = a kJ·mol-1
反应Ⅱ:NH2COONH4(l) NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
① 已知NH3(l) NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)
NH2CONH2(l) + H2O(l) Δ H4=kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是。
② 一定条件下,往恒容密闭容器中投入4 mol NH3和 1 mol CO2 , 测得各组分物质的量随时间变化如图1。下列说法正确的是。

A.选择合适的碳氮比有利于提高产率
B.反应Ⅰ的活化能比反应Ⅱ小
C.过量氨气可以与反应生成的水结合,有利于尿素合成
D.气体物质的量不再变化时,反应达到平衡状态

① 其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是(填“温度”或“压强”)。

② 其它条件一定时,向2 L密闭容器中加入n mol CH4和2 mol NH3 , 平衡时NH3体积分数随n变化的关系如图所示。平衡常数K=(请写出计算过程)

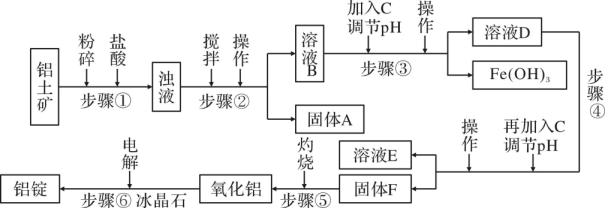
一些难溶物开始沉淀和完全沉淀的 pH 如表所示:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀 pH(离子初始浓度为 0.01mol·L-1) | 4 | 2.3 | 10.4 |
完全沉淀 pH(离子浓度<10-5mol·L-1) | 5.2 | 3.2 | 12.4 |
请回答下列问题:
a.Fe b.氨 c.过量氢氧化钠稀溶液