








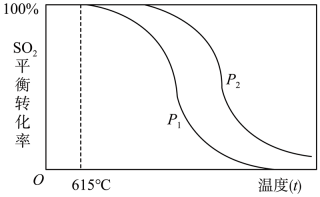
①根据上述信息可以判断:P1P2(填“>”、“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K将(填“变大”、“变小”或“不变”)。
③SO2废气的另一种处理方法是用Na2SO3溶液吸收,得到NaHSO3溶液。

配平步骤①涉及到的方程式(先在括号里补齐生成物):
_Fe2 (SO4)3 + _ H2S =_FeSO4 +_S↓ +_
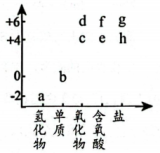
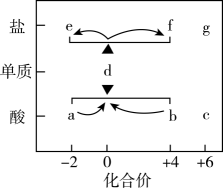
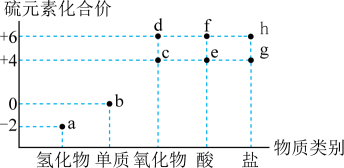
从图1中选择符合图2要求的X代表的物质:X。



装置乙的作用是。若X为品红溶液,观察到溶液褪色,说明SO2具有(填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有。
a.氧化性 b.还原性 c.漂白性 d.酸性
Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-++H+
|
装置 |
编号 |
试剂 |
实验现象 |
|
|
a |
碘水 |
溶液的棕黄色褪去 |
|
b |
Fe2(SO4)3溶液 |
|
a中反应的离子方程式为。
实验①向第一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀。
实验②向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
实验③向第三份溶液中先加入稀盐酸酸化,再加入BaCl2溶液,产生白色沉淀。
上述实验不能证明SO2与Fe3+发生了氧化还原反应的是 ,原因是。
|
装置 |
编号 |
试剂 |
实验现象 |
 |
c |
3mol·L-1稀硫酸 |
始终无明显变化 |
|
d |
3 mol·L-1稀盐酸 |
铜片表面变黑,溶液变为棕色 |
已知:i.水合Cu+既易被氧化也易被还原,因此水溶液中无法生成水合Cu+。
ii.CuCl为白色固体,难溶于水,可溶于c(Cl-)较大的溶液生成[CuCl3]2-。
证明d所得棕色溶液含有[CuCl3]2- :用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因是。

储能材料是当今科学研究的热点,C60(结构如图)可用作储氢材料。继C60后,科学家又合成了Si60、N60 , 下列有关说法正确的是。

a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145-140pm,故C60熔点高于金刚石
上述反应中,反应物之一在熔融状态下不导电,该物质属于晶体。写出气体产物的电子式,其属于分子(填“极性”或“非极性”)。
找出其中一个变化与“ →Mn2+”组成一个反应,写出该反应的离子方程式并配平。
①由此可知,高锰酸根离子( )反应后的产物与有关。
②高锰酸钾溶液与硫化亚铁发生如下反应:10FeS+6KMnO4+24H2SO4→3K2SO4+6MnSO4+5Fe2(SO4)3+10S↓+24H2O,已知该反应进行一段时间后,固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为个。