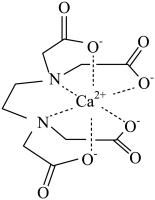
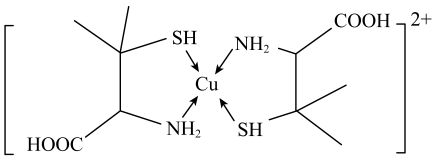



已知:向的溶液中加入KSCN溶液生成蓝色的
的配离子;
不能与
形成配位离子。下列说法正确的是( )

Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入研细的
, 得到
沉淀。
Ⅱ.边搅拌边慢慢滴入足量溶液,得到
溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到产品。
回答下列问题:

A.离子键 B.极性键 C.范德华力 D.氢键 E.配位键


①该物质的化学式为。
②每个Mg原子距离最近的Ni原子的个数是。
③若用NA表示阿伏加德罗常数的值,如果晶体的密度为ρg/cm3 , 则该晶胞的体积为nm3(用含ρ、NA的代数式表示)。
现有的配合物
, 其中配离子是,配位数为;在0.2mol该配合物溶液中滴加足量的
溶液,产生沉淀的物质的量为。