 B . 称量NaOH
B . 称量NaOH  C . 量取所需的水
C . 量取所需的水 D . 读取水的体积
D . 读取水的体积

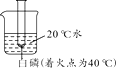


 B .
B .  C .
C .  D .
D . 
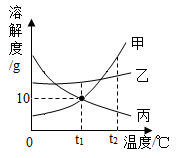

温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | ||



| 物质m | 物质n | 现象推测 | 原理分析 |
① | 稀硫酸 | 锌粉 | 逐渐鼓起并保持 | Zn+H2SO4═ZnSO4+H2↑ 反应产生气体,内压保持不变 |
② | 水 | 硝酸铵固体 | 逐渐变瘪并保持 | 硝酸铵溶于水,温度降低,内压减小并保持 |
③ | 氢氧化钠溶液 | 二氧化碳 | 逐渐变瘪并保持 | 2NaOH+CO2═Na2CO3+H2O 反应消耗气体,内压减小并保持 |
④ | 水 | 生石灰 | 逐渐鼓起,慢慢恢复 | CaO+H2O═Ca(OH)2反应放热,温度升高,反应结束一段时间后恢复常温,内压先增大后恢复 |




|
|
|
|
A.20℃时,向一定量硝酸钾不饱和溶液中加入硝酸钾固体 | B.向一定量NaOH溶液中加稀盐酸 | C.电解水 | D.向盛有少量二氧化锰的烧杯中不断加入 |



A.将螺母向左调 B.取下一部分砝码 C.向左盘添加氯化钠 D.将螺母向右调
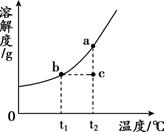
【资料】下表是氯化钠和碳酸钠在不同温度下的溶解度。
温度(℃) | 0 | 10 | 20 | 30 | 40 | |
溶解度(g/100g水) | Na2CO3 | 7.0 | 12.5 | 21.8 | 39.7 | 48.8 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | |
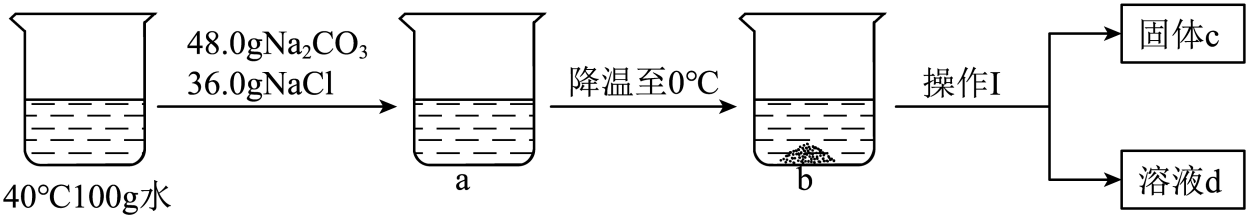
①a溶液中的溶剂是水,水中氢、氧元素的质量比为。
②操作Ⅰ的名称是。
③定量分析固体c的成分是(写出各组分及其质量)。

①从上述流程可知,“夏日晒盐”是通过(选填“蒸发结晶”或“降温结晶”)实现的。
②常温下,析出粗盐晶体后的母液,对于氯化钠来说是(填“饱和”或“不饱和”)溶液。
Ⅰ.分析碱的化学性质(如图1)

实验结束后,小组同学对B试管中上层清液的溶质成分产生疑问,作出猜想:
猜想一:只含有
猜想二:含有、
猜想三:、
实验结论 | 实验现象 | 实验操作 |
在试管甲中滴加足量稀盐酸 | 无气泡产生 | 猜想不成立 |
在试管乙中滴加碳酸钠溶液 | 猜想三成立 |

图丙表明酸和碱的反应为(填“吸热”或“放热”)反应。
A.试纸 B.硝酸银溶液 C.碳酸钙