混合物 | 酸 | 碱 | 盐 | 氧化物 | |
A | 冰水混合物 | 硫酸 | 氢氧化钠 | 硫酸钡 | 干冰 |
B | 焦炉煤气 | 硝酸 | 氢氧化钙 | 碳酸氢钙 | 四氧化三铁 |
C | 合金 | 盐酸 | 碱式碳酸铜 | 氯化银 | 一氧化碳 |
D | 空气 | 醋酸 | 氢氧化钡 | 碳酸钙 | 氯酸钾 |

选项 | 物质 | 目的 | 主要实验操作 |
甲 | CO、CH4气体 | 鉴别 | 点燃,火焰上方罩干冷烧杯,观察现象 |
乙 | Na2CO3(NaOH)溶液 | 检验 | 滴加酚酞试液,观察溶液颜色的变化 |
丙 | HCl(H2SO4)固体 | 除杂 | 加入适量BaCl2溶液 |
丁 | MnO2、KCl 固体 | 分离 | 溶解、过滤、洗涤、烘干、蒸发 |


A.熟石灰 B.一氧化碳 C.武德合金 D.硝酸铵 E.硫酸铜 F.肥皂水 G.氢氧化钠 H.纯碱

表1 相关物质的溶解度(20℃)(单位:g)
NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
36.0 | 21.7 | 9.6 | 37.2 |

在上述操作中,如何判断晶体已经洗涤干净。
【提出问题】
灰白色沉淀是什么物质?
【猜想假设】
小华认为灰白色沉淀为碳酸镁(MgCO3),其他同学认为不需要实验就能否定小华的猜想,理由是.
小宇认为由于反应后氯化镁的生成量偏多,灰白色沉淀为不能再溶解的氯化镁固体.
小彤认为灰白色沉淀为脱落的镁粉细颗粒.
【实验探究1】
实验操作 | 现象 | 结论 |
①取试管中的上层清液,加入适量的氯化镁固体 | 氯化镁固体 (选填“溶解”或“不溶解”) | 小宇猜想错误 |
②取适量白色沉淀加入足量稀盐酸中 | (选填“有”或“没有”)气泡冒出 | 小彤猜想错误 |
基于以上探究与分析,原有猜想均遭到了否定.
【查阅资料】
HCl+AgNO3═HNO3+AgCl↓,AgCl是一种白色沉淀.
【实验探究2】
他们又另取灰白色沉淀放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管内,玻璃棒上的溶液出现白色浑浊,证明产生了气体.再将湿润的蓝色石蕊试纸悬于试管口,试纸变色.
同学们请教老师后得知,足量的镁与稀盐酸反应时,溶液会经历从酸性到碱性且碱性逐步增强的过程,从而生成了碱式氯化镁沉淀.据文献介绍,碱式氯化镁存在多种组成结构,化学通式可表示为Mgx(OH)yClz•mH2O(其中2x﹣y﹣z=0,0≤m≤6).
【反思拓展】
①做镁与稀盐酸反应的实验时,镁条的用量宜少不宜多.
②铁片和铜片放入稀硫酸中产生的现象也不相同,据此推测出铁的活性比铜.还可根据铁和硫酸铜溶液的反应来确定这两种金属的活动性强弱,该反应的化学方程式为.
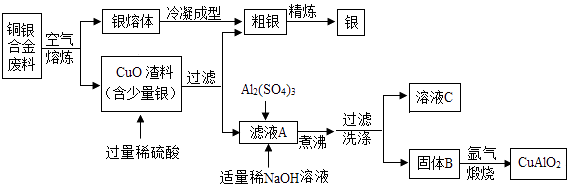
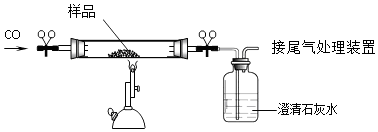
【资料】Ⅰ.难溶性碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化.银在空气中不易被氧化.
请回答下列问题: