
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
 4NH3(g)+5O2(g)
4NH3(g)+5O2(g)  N2(g)+3H2(g)
N2(g)+3H2(g)  2SO3(g)
2SO3(g)  2N2O5(g)
2N2O5(g) 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是 ( )
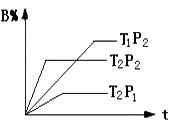
①压强 P1P2;(a+b)(c+d)(填“>”或“<”下同).
②温度t1℃ t2℃;△H0.
③保持体积和温度不变,通入He,平衡会移动(填“正向”、“逆向”或“不”).
化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题.
(1)一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)⇌2C(g)△H>0,起始时,c(A)=0.2mol/L,c(B)=0.6mol/L,c(C)=0.4mol/L.当平衡时,下列数据可能存在的是
a.c(A)=0.4mol/L b.c(B)=1.0mol/L
c.c(A)=0.3mol/L且c(C)=0.2mol/L d.c(C)=1.0mol/L
若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是
a.增加A的物质的量 b.减压
c.升温 d.使用催化剂
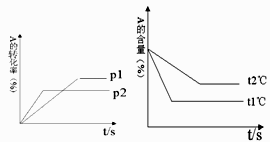
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.
则图中表示醋酸溶液中pH变化曲线的是 (填“a”或“b”).设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 , 则m1 (选填“<”、“=”、“>”)m2 .

①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
Ⅰ.C(g)+CO2(g) 2CO(g) ΔH=+172.5kJ/mol
Ⅱ.CO(g)+2CuO(s) Cu2O(s)+CO2(g)ΔH=-138.0KJ/mol
请回答:
①0-5min内,用CO2表示的反应速率v(CO2)=.
②CO的平衡转化率a=.

①能表示CO2的平衡体积分数与温度关系的曲线为(填"L1”或“L2”),理由为。
②温度为T1时,该反应的平衡常数K=。
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=,此温度下,该反应的平衡常数K=
②能说明上述反应达到平衡状态的是。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是 ,压强p1、P2、P3的大小关系是,理由是。

①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:。

②已知:N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g) 2NH3(g)△H=-bk/mol
2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H=。