![]()

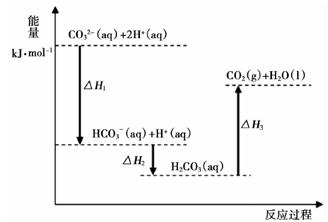
4Al(s)+3O2(g)═2Al2O3(s)△H1①
4Al(s)+2O3(g)═2Al2O3(s)△H2②
3O2(g)═2O3(g)△H3③
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中 ![]() =(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2 , Ka2=6.0×10-8)。
=(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2 , Ka2=6.0×10-8)。
|
n(SO32-):n(HSO3-) |
99:1 |
1:1 |
1:99 |
|
pH |
8.2 |
7.2 |
6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为。
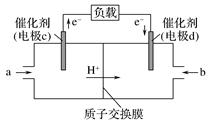
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是(填“正极”或“负极”),c电极的反应方程式为。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=(不考虑溶液体积变化)。
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=。
|
H2(g) |
Br2(l) |
HBr(g) |
|
|
1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为。
②CO(g)+2H2(g)=CH3OH(g)△H=-129kJ·mol-1
写出由CH4和H2O(g)生成CH3OH和H2的热化学方程式 。
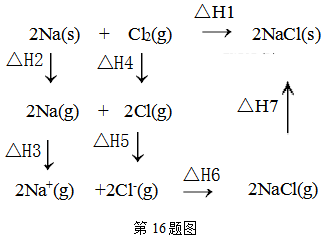
Ⅰ.4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) △H1
Ⅱ.2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) △H2
则△H=(用△H1、△H2表示)。

①反应开始到10 min时,Cl2的平均反应速率v(Cl2)=。
②温度为了T2时,该反应的平衡常数K=L·mol-1。
|
序号 |
C(ClNO)/mol·L-1 |
vmol·L-1·s-1 |
|
① |
0.30 |
3.6×10-8 |
|
② |
0.60 |
1.44×10-7 |
|
③ |
0.90 |
3.24×10-7 |
n=;k=(注明单位)。

①请填写下表中的空白:
|
温度 实验次数 |
起始温度T1/℃ |
终止温度 T2/℃ |
温度差平 均值(T2 -T1)/℃ |
||
|
H2SO4 溶液 |
NaOH 溶液 |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3 , 中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
回答下列问题

①反应(Ⅱ)的△H(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。