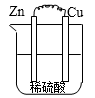
 B .
B .  C .
C . 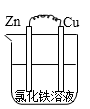 D .
D . 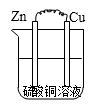
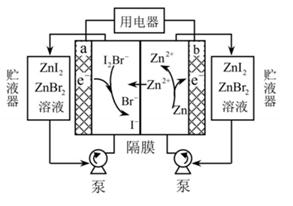
下列说法正确的是( )

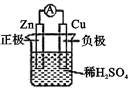 B .
B . 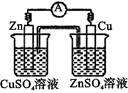 C .
C .  D .
D . 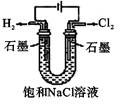

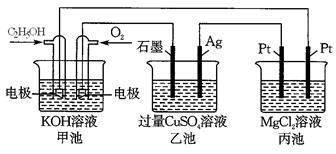
① 已知上述反应中生成 1 mol NH3 放出 46 kJ 热量,该反应的热化学方程式为。
②该反应放热,但仍选择较高温度。其原因是。
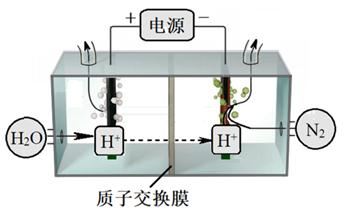
① 阴极生成氨的电极反应式为。
② 阳极氧化产物只有 O2。电解时实际生成的 NH3 的总量远远小于由 O2 理论计算所得 NH3 的量,结合电极反应式解释原因:。
![]()
已知:氮原子利用率是指目标产物中氮的总质量与生成物中氮的总质量之比
上述反应③的氮原子利用率为 66.7%。要使原料 NH3 转化为 NH4NO3 的整个转化过程
中氮原子利用率达到 100%,可采取的措施是

a.用纯氧气代替具支试管内的空气
b.将食盐水浸泡过的铁钉表面撒上铁粉和碳粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ•mol﹣1
③H2O(g)=H2O(l)△H3=﹣44.0kJ•mol﹣1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为。
②X轴上a点的数值比b点(填“大”或“小”)。
③生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
一定条件下CH4的平衡转化率与温度、压强的关系如图1.则T1T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为。

