
| T/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
对该反应而言,下列说法正确的是( )
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动



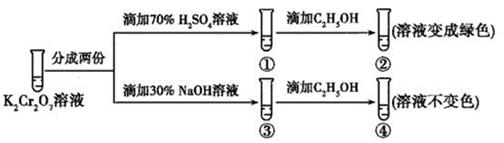
结合实验,下列说法错误的是( )
①要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的来实现;
②在KMnO4与H2C2O4反应中,可通过观察单位时间内变化来测定该反应的速率;写出该反应的离子方程式:
③在Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O反应中,该反应速率的快慢可通过来判断。
|
实验序号 |
反应温度/℃ |
Na2S2O3浓度 |
稀硫酸 |
H2O |
||
|
V/mL |
c/(mol/L) |
V/mL |
c/(mol/L) |
V/mL |
||
|
① |
20 |
10.0 |
0.10 |
10.0 |
0.50 |
0 |
|
② |
40 |
V1 |
0.10 |
V2 |
0.50 |
V3 |
|
③ |
20 |
V4 |
0.10 |
4.0 |
0.50 |
V5 |
该实验①、②可探究对反应速率的影响,因此V1和V3分别是、。
实验①、③可探究硫酸浓度对反应速率的影响,因此V5=。
|
温度/℃ |
200 |
300 |
400 |
500 |
600 |
|
氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13.8 |
请回答:

已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为。
