A.食盐 B.纯碱 C.硝酸钾 D.硫酸钾 E.聚乙烯 F.小苏打

|
阴离子 阳离子 |
OH- |
NO3- |
CO32- |
Cl- |
|
K+ |
溶 |
溶 |
溶 |
溶 |
|
Ba2+ |
溶 |
溶 |
不 |
溶 |
|
Cu2+ |
不 |
溶 |
不 |
溶 |
(提出问题)烧杯中溶液的溶质成分是什么?
张南同学猜想溶质成分是:NaNO3、NaCl、HCl
小岗同学猜想溶质成分是:NaNO3、NaCl、Na2CO3
你的猜想是;
张南猜想的理由是。
张南同学为了验证自己的猜想取少量滤液于试管中,向其中滴加少量硝酸银溶液观察到有白色沉淀的实验现象,于是得出结论:自己的猜想正确。请对张南同学由实验得出的的结论进行评价;
通过上述张南、小岗两位同学对溶液溶质成分的猜想,总结出猜想所得溶液中溶质成分时除需考虑可溶性的生成物和可溶性的反应物外,还需考虑的物质。
|
试管编号 |
① |
② |
③ |
④ |
|
试管内试剂 |
NaOH溶液 |
MgCl2溶液 |
Na2CO3溶液 |
Ba(NO3)2溶液 |
|
加入硫酸后的现象 |
无明显现象 |
无明显现象 |
产生气泡 |
白色沉淀生成 |
[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2 , 即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42-会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
[设计方案]

沉淀A的化学式是。
老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂改成。
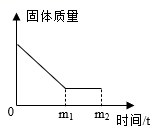
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是。
[实验反思]小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是。
(资料查阅)上述四种物质的相关信息如下:
|
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
|
常温下的溶解度/g |
36 |
109 |
21.5 |
9.6 |
|
常温下稀溶液的pH |
7 |
13 |
11 |
9 |
请回答下列问题:
(实验探究1)

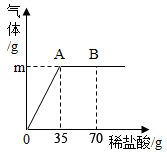
如上图乙所示,在操作①后可确定溶质不是NaCl,则实验现象应是;在进行操作②时有无色无味气体产生,由此又可排除的物质是。
(探究结论)分析四种物质的相关信息,你认为该溶液中的溶质可能是上述四种物质中的,你的判断依据是。若上述探究结论是正确的,操作②发生反应的化学方程式为。
(讨论质疑)有同学认为以上分析不严密,需要进一步实验确定,于是又进行了如下探究。
(实验探究2)向操作①后试管中的溶液中滴加过量CaCl2溶液(中性),充分反应后,试管中溶液颜色不变,又有白色沉淀产生。
(得出结论)通过实验探究2可确定原瓶溶液中的溶质应该是。
(反思拓展)造成该溶液出现上述实验现象的原因是(用化学方程式表示)。
![]()
a.KHCO3溶解度较大
b.KHCO3溶解度较小
c.K2CO3溶解度较大
d.K2CO3溶解度较小

已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。