| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 182 | 191 | 204 | 238 | 287 | 362 | 487 |
 B .
B . 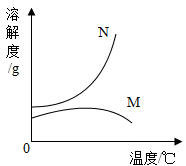 C .
C .  D .
D . 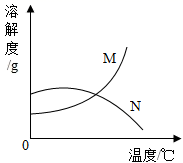
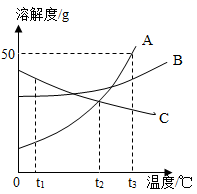
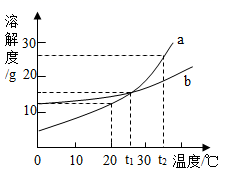
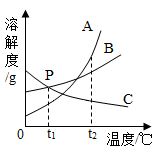
①t1℃时,A、B、C三种物质的溶解度由大到小的顺序是。
②当温度在t2~t3℃之间时,A物质与B物质(填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是。
④t3℃时将75gA的饱和溶液稀释成20%的溶液需加g水。

|
序号 |
温度 |
水质量 |
加入NaCl质量 |
溶液质量 |
|
① |
20℃ |
25g |
9g |
34g |
|
② |
20℃ |
50g |
20g |
68g |
|
③ |
20℃ |
100g |
34g |
134g |
|
④ |
20℃ |
150g |
54g |
204g |
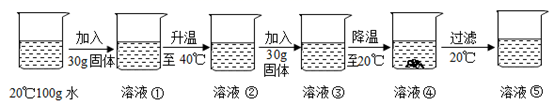
上述实验中,所得溶液为饱和溶液的是(填数字序号)。

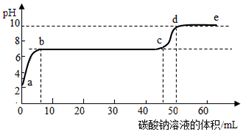
① a点表示。
② 60℃时,50g水中加入g硝酸钾恰好形成饱和
溶液,再往该溶液中加入115g水后,硝酸钾溶液的溶质
质量分数是。
③ 提纯混合溶液中的硝酸钾,进行如下实验。

操作II的名称为,溶液M中所含溶质为 。
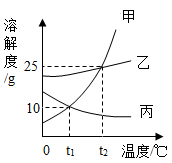
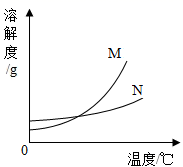
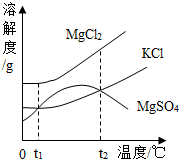
④ 20℃时,将等质量的NaCl、KNO3固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如
图1,加热到60℃时现象如图2(不考虑水分蒸发)。根据NaCl、KNO3物质的溶解度曲线回答:
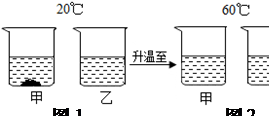
甲烧杯中加入的固体是(填“KNO3”或“NaCl”)。
对乙烧杯中溶液的分析,正确的是(选填编号)
Ⅰ.从20℃升温到60℃,溶质质量没有改变 Ⅱ.若对20℃溶液降温,一定会析出晶体
Ⅲ.20℃时,溶质与溶剂的质量比为31.6:100 Ⅳ.60℃时,溶液一定是不饱和溶液
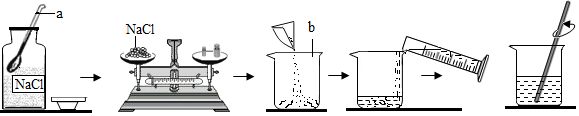
①把1.0g药品溶于水配制成4.0mL溶液a;
②取0.4mL溶液a,加水稀释至1.0mL,得溶液b。
由于在配制过程中药液很稀,其密度都可近似看作1g·cm-3 , 则最终得到的药液(溶液b)中溶质的质量分数为。
如下图所示,同学们设计了不同的实验方案进行探究:
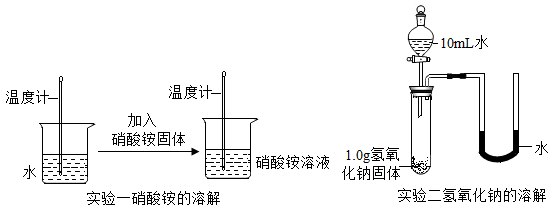
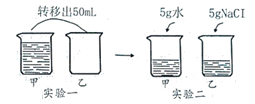
实验一中的硝酸铵溶解后,溶液温度(填“升高”、“降低”或“不变”)。
如下图所示,同学们用氢氧化钠溶液进行了下列实验,请分析并回答下列问题:
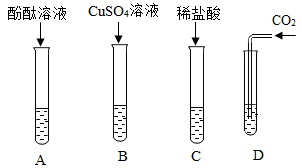
A试管中观察到的现象是。
①为了证明D中已发生化学反应,向该试管中再加入足量的,观察到有气泡产生。
②为了证明氢氧化钠溶液和稀盐酸能发生化学反应,同学们设计并进行了如下实验:(所用稀盐酸经估算确保过量)
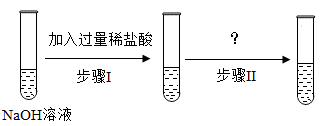
整个实验过程中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应。请写出步骤Ⅱ中所加试剂。
实验室中的应用
实验室中能用氢氧化钠溶液吸收的气体是(填字母)。
a、二氧化碳
b、水蒸气
c、氯化氢
d、氧气
吸收上述所选气体,一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的不同。
氢氧化钠常用于制造人造丝、造纸、炼油、纺织、印染与橡胶工业。某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸4.9t(H2SO4的质量分数为20%),可以处理的废水质量是t。
结合化学方程式中的数据分析:若将等质量、等溶质质量分数的稀硫酸和氢氧化钠溶液混合,充分反应后,请判断溶液中一定含有的溶质,并简述你的判断理由:。
|
次数 |
1 |
2 |
3 |
4 |
5 |
6 |
|
加入稀盐酸质量/g |
10 |
10 |
10 |
10 |
10 |
10 |
|
剩余固体质量/g |
9.0 |
7.0 |
m |
3.0 |
1.1 |
n |
请根据以上信息回答下列问题: