 B .
B .  C .
C .  D .
D . 
| 压强/ (×105Pa) | 温度/℃ | NO达到所列转化率需要的时间/s | ||
| 50% | 90% | 98% | ||
| 1.0 | 30 | 12 | 250 | 2830 |
| 90 | 25 | 510 | 5760 | |
| 8.0 | 30 | 0.2 | 3.9 | 36 |
| 90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法错误的是( )
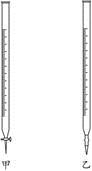
| 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |



A.H2(g)+ O2(g)=2H2O(g) ∆H1
B.C(s)+ O2(g)=CO(g) ∆H2
C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
|
实验 混合溶液 |
A |
B |
C |
D |
E |
F |
|
4mol•L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中: V2=,V6=,V10=。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
①写出酸H2A的电离方程式:
②若溶液M由10 mL 2 mol∙L-1 NaHA 溶液与10 mL2 mol∙L-1 NaOH溶液混合而得,则溶液M的pH(填“>”“<”或“=”)7,溶液M中各粒子的浓度关系正确的是(填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+2c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
D.c(A2-)+c(HA-)=1mol∙L-1
a.向溶液A中加适量水 b.向溶液A中加适量 NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
| n( | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断 NaHSO3溶液显性。
②当吸收液呈中性时,溶液中离子浓度的大小关系为
①使纯H2缓慢地通过处于721℃下的过量氧化钴 CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0192。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0250。根据上述实验结果判断,还原CoO( s)为Co(s)的倾向是COH2(填“大于”或“小于”)。

①由图可推知该反应的∆H0(填>、<、=,下同)平衡常数K(300℃)K(400℃)
②曲线C代表进料浓度比c(HCl):c(O2)为,设HCl初始浓度为c0 , 根据进料浓度比c(HCl):c(O2)=4:1的数据计算K(400℃)=(列出计算式)。
③按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过高的不利影响是。
④Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ∆H1=+89kJ∙mol-1
CuCl(s)+ O2(g)=CuO(s)+
Cl2(g) ∆H2=-25 kJ∙mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ∆H3=-120 kJ∙mol-1
则4HClg)+O2 (g)=2Cl2(g)+2H2O(g)的∆H=kJ∙mol-1

已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
|
开始沉淀时的pH |
3.7 |
2.3 |
7.6 |
5.4 |
|
完全沉淀时的pH |
5.2 |
3.2 |
9.7 |
6.7 |
回答以下问题: