| 容器 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )

| 组别 | | 温度/℃ | 状态 |
| ① | 2.0 | 25 | 块状 |
| ② | 2.5 | 30 | 块状 |
| ③ | 2.5 | 50 | 粉末状 |
| ④ | 2.5 | 30 | 粉末状 |

①升高温度 ②改用100mL 3mol/L盐酸
③再加300mL 1mol/L盐酸 ④用等量铁粉代替铁片
⑤改用100mL 98%的硫酸 其中能使反应速率加快的是( )
 B .
B .  C .
C .  D .
D . 
(t1时刻v正=v逆;t1时改变条件,t2时重新建立平衡)
 B . 增加SO3浓度
B . 增加SO3浓度  C . 升高温度
C . 升高温度  D . 增大压强
D . 增大压强 

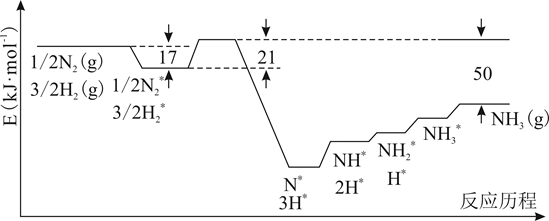
氨气的脱附是(填“吸热”或“放热”)过程,合成氨的热化学方程式为。
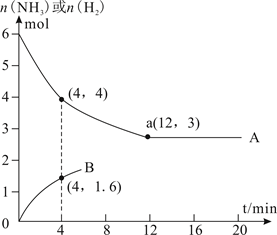
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2 , 试说明理由。
|
助剂 |
CO2转化率(%) |
各产物在所有产物中的占比(%) |
||
|
C2H4 |
C3H6 |
其他 |
||
|
Na |
42.5 |
35.9 |
39.6 |
24.5 |
|
K |
27.2 |
75.6 |
22.8 |
1.6 |
|
Cu |
9.8 |
80.7 |
12.5 |
6.8 |
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是。
|
实验 编号 |
室温下,试管中所加试剂及其用量/mL |
室温下溶液颜色褪至无色所需时间/min |
|||
|
0.6mol·L-1H2C2O4溶液 |
H2O |
0.2mol·L-1KMnO4溶液 |
3mol·L-1稀硫酸 |
||
|
1 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
|
2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
|
3 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
请回答:
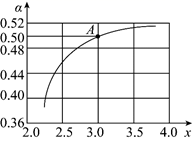
一定能判断该反应达到化学平衡状态的是_______。