| | | | |
| A | B | C | D |

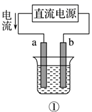

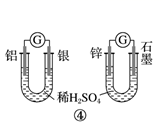
 B .
B . 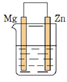 C .
C . 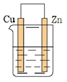 D .
D . 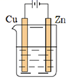
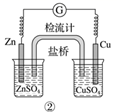
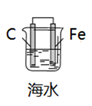 模拟吸氧腐蚀
B .
模拟吸氧腐蚀
B .  电解法制氯气
C .
电解法制氯气
C . 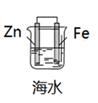 铁的防护
D .
铁的防护
D . 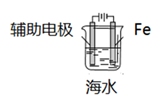 外加电流的阴极保护法
外加电流的阴极保护法
已知:2Li2O(s)+SiO2(s)=Li4SiO4(s) ΔH1=akJ⋅mol-1
Li2CO3(s)+SiO2(s)=Li2SiO3(s)+CO2(g) ΔH2=bkJ⋅mol-1
Li2SiO3(s)=Li2O(s)+SiO2(s) ΔH3=ckJ⋅mol-1
则2Li2CO3(s)+SiO2(s)=Li4SiO4(s)+2CO2(g) ΔH=kJ⋅mol−1(用含a、b、c的式子表示)。
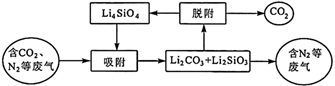
“吸附”过程中主要反应的化学方程式为。
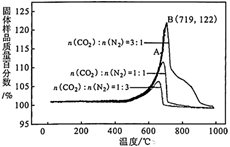
①该反应为反应(填“吸热”或“放热”)。
②A点的v正v逆(填“>”、“<”或“=”),理由是。
③不同CO2的体积分数对于吸附速率的影响是。
④保持B点的温度不变,若所用刚性容器体积为原来的一半,则平衡时理论上c(CO2)较原平衡(填“增大”、“减小”或“不变”)。
⑤B点CO2的吸收率为(保留3位有效数字)。
Ⅰ.热化学转化法:工业上常用 催化加氢合成
。
已知:①
②
③
反应 的
kJ/mol。
在该工业生产中,选用了高活性的Ni基催化剂,并且在低温下进行,其目的是:。
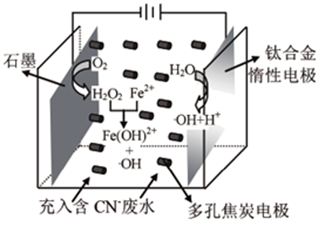
Ⅱ.电化学转化法:多晶Cu可高效催化 甲烷化,电解
制备
的原理示意图如下。
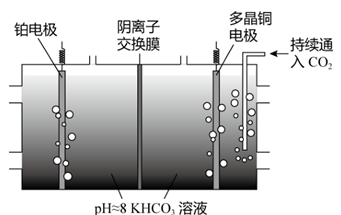
①多晶铜连接电源的极。(填“正”或“负”)
②阳极氧化产物只有 ,电解时实际生成
的总量小于由
理论计算所得
的量,结合电极反应式解释原因:。
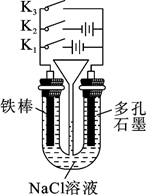
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

此过程中能量转化形式为转化为(填“化学能”或“电能”)
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
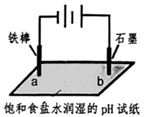
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

被腐蚀的是包裹的铁钉(填“锌片”或“铜片”)
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
|
装置 |
编号 |
电极A |
溶液B |
操作及现象 |
|
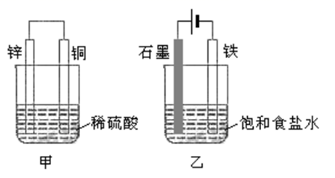
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
① 同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
② 针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
|
编号 |
溶液B |
操作及现象 |
|
Ⅲ |
经煮沸的pH=2的 H2SO4 |
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
|
Ⅳ |
pH=2的H2SO4 |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
|
Ⅴ |
pH=12的NaOH |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
① 丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。