| 选项 | 操作 | 现象和结论 |
| A | 向反应后溶液中滴加BaCl2溶液 | 生成白色沉淀,说明硫酸过量 |
| B | 将少量NaOH固体投入稀硫酸中 | 溶液温度升高,说明中和反应放热 |
| C | 向NaOH溶液中滴加无色酚酞试液,然后向其中逐滴滴加稀硫酸 | 溶液由红色刚刚变成无色,证明二者恰好完全反应 |
| D | 向反应后溶液中加入CuO粉末 | 生成蓝色沉淀,说明氢氧化钠过量 |



①A+B ②A+E
③A+D ④ D+E



①检查装置气密性,在锥形瓶内加入样品10.6g和适量的水并放出热量,并连接好仪器;
②打开分液漏斗活塞,将稀盐酸缓缓注入锥形瓶中,使样品恰好完全反应,准确测得量筒内共收集到1100mL的水(装有水的广口瓶的水面上方铺有一层油);
③拆下装置后,往锥形瓶内的溶液中注入足量硝酸银溶液,至沉淀完全,经过滤、洗涤和干燥后,称量沉淀质量。
注:本实验条件下,二氧化碳的密度2g/L。
【猜想与假设】猜想一:Na2CO3猜想二:Na2CO3和Na2O2
猜想三:Na2CO3和NaOH猜想四:
|
操作 |
现象 |
结论 |
|
① 取少量样品于试管中,加入足量的水,振荡 |
固体完全溶解,且 |
样品中一定没有 Na2O2 |
|
② 取少量实验①所得溶液于另一试管中,加入过量的 BaCl2溶液振荡 |
有白色沉淀产生 |
猜想三正确 |
|
③ 取少量实验②所得的上层清液于另一试管中,加入过量的溶液,振荡。 |
有蓝色沉淀产生 |
猜想①:样品成分是 Ca(OH)2 ;
猜想②:样品成分是 Ca(OH)2 和 CaCO3 ;
猜想③:样品成分是 。
小红设计实验并根据现象得出相应结论:
|
实验 |
实验步骤 |
实验现象 |
实验结论 |
|
1 |
取熟石灰样品放入烧杯中,加水溶解,过滤; |
分离出滤液,滤纸上残留白色固体 |
样品中有 CaCO3 |
|
2 |
向滤液中加入适量无色酚酞溶液 |
溶液变红色 |
样品中有 Ca(OH)2 |
小红得出结论:熟石灰样品的主要成分 Ca(OH)2 和 CaCO3 。




|
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
|
|
加入氢氧化钠溶液质量(g) |
25 |
25 |
25 |
25 |
25 |
25 |
|
反应后溶液总质量(g) |
149.5 |
174.5 |
194.6 |
209.8 |
225 |
250 |
|
每次产生沉淀质量(g) |
0 |
0 |
4.9 |
m |
9.8 |
0 |
|
(硝酸铵)(NH4NO3) 硝酸铵含量>95% 净重:50Kg 含氮量:34.3% |

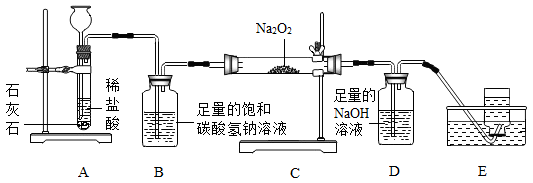
已知,装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物.整套装置气密性良好,反应所需试剂均足量.
2Na2O2+2CO2═2Na2CO3+O2
相关实验数据如下:
|
Na2O2样品的质量/g |
D反应前物质的质量/g |
D反应后物质的质量/g |
|
40g |
222g |
236g |