 B . 铁丝在氧气中燃烧
B . 铁丝在氧气中燃烧  C . 称量物体的质量
C . 称量物体的质量  D . 蒸发氯化钠溶液
D . 蒸发氯化钠溶液 
|
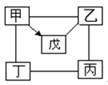
甲 |
乙 |
丙 |
丁 |
戍 |
|
|
A |
Na2CO3 |
Ca(OH)2 |
NaOH |
HCl |
CO2 |
|
B |
HCl |
Fe2O3 |
H2SO4 |
Zn |
CuCl2 |
|
C |
C |
CuO |
HCl |
O2 |
CO |
|
D |
A1 |
H2SO4 |
NaOH |
CuCl2 |
A12O3 |
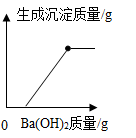 B .
B . 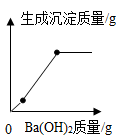 C .
C . 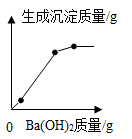 D .
D . 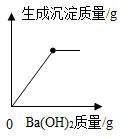
①K2CO3+CaCl2 ②H2SO4+KCl ③CuO+HCl ④Fe+CuSO4
⑤CO2+NaOH ⑥K2SO4+BaCl2 ⑦Mg(OH)2+CuSO4 ⑧BaCO3+NaOH.

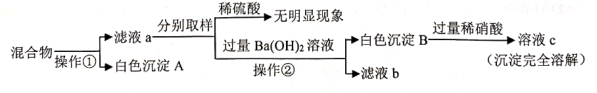
①在A装置的锥形瓶中加入大理石,向长颈漏斗中注入稀盐酸。
②打开a、c ,关闭b,向B中集气瓶内充入气体。
③关闭a、c,打开b,用冷毛巾捂住B中集气瓶,一段时间后,观察到B装置中烧杯内液面 (填 “上升”、“下降”或“不变”)。


①香兰素中碳元素和氧元素的质量之比。
②由香兰素的乙醇溶液得到香兰素的过程属于变化。
③以上提取香兰素的过程中,操作1的名称是。
④超临界CO2流体按元素的组成分类属于。
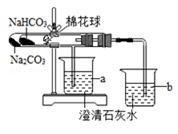
①加热一段时间后,a、b两烧杯分别看到的现象是;
由此可得出的结论是;
②碳酸氢钠分解的化学反应方程式:;
③该装置设计的优点是;
④实验中应注意的问题是。

|
实验次数 |
1 |
2 |
3 |
4 |
|
加入氯化钡溶液的质量/g |
10 |
10 |
10 |
10 |
|
烧杯中所得溶液的质量/g |
28.03 |
36.06 |
44.09 |
54.09 |

试分析计算回答:


|
第1次 |
第2次 |
第3次 |
第4次 |
|
|
加入稀硫酸质量(g) |
100 |
100 |
100 |
100 |
|
剩余固体质量(g) |
87 |
74 |
67.5 |
67.5 |


|
实验步骤 |
实验现象 |
实验结论 |
|
①取滤液样品于试管中,加入 |
若有气泡冒出,且红色消失 |
原废液中的溶质为:Na2CO3 , NaOH |
|
②另取滤液样品于试管中,加入碳酸钠溶液 |
若有白色沉淀出现,红色不消失 |
原废液中的溶质为: |
【建立猜想】①氢氧化钡过量 ②盐酸过量 ③ 两者恰好完全反应
【实验设计】
步骤一:取少量反应后的溶液于试管中,滴入几滴无色酚酞试液,溶液不变色,得出猜想①错误。
步骤二:继续探究
|
实验方案 |
实验操作 |
实验现象 |
实验结论 |
|
Ⅰ |
重新取样,滴加少量AgNO3溶液 |
白色沉淀 |
猜想②正确 |
|
Ⅱ |
重新取样,滴加足量Na2CO3溶液 |
________ |
猜想②正确 |
|
白色沉淀 |
猜想③正确 |
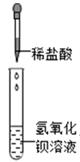
A.紫色石蕊试液
B.二氧化碳
C.镁条
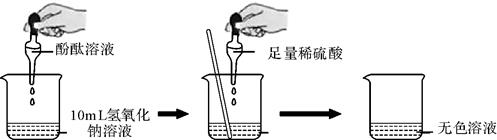
根据上图所示实验,当看到烧杯中溶液颜色发生了怎样的变化?答:。
由此可确定稀硫酸与氢氧化钠溶液发生了化学变化。
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
|
实验方案 |
实验步骤 |
实验现象 |
实验结论 |
|
方案一 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
稀硫酸过量 |
|
方案二 |
取样,滴入几滴紫色石蕊试液 |
溶液变红 |
稀硫酸过量 |
上述设计的实验方案中,正确的是(填“方案一”或“方案二”)。请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是,实验可能的现象及对应的结论是。