 B . 测反应后溶液的pH
B . 测反应后溶液的pH C . 收集氢气
C . 收集氢气 D . 回收锌粒
D . 回收锌粒
 B . 加入药品
B . 加入药品  C . 收集气体
C . 收集气体  D . 验满
D . 验满 
 B . 收集
B . 收集  C . 检验二氧化碳
C . 检验二氧化碳  D . 验满
D . 验满 


①都不需要对气体发生装置加热
②都可以用排水法收集气体
③都可以用向上排空气法收集气体
④都可以用相同的发生装置


 B .
B . 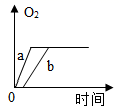 C .
C .  D .
D . 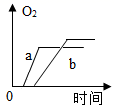
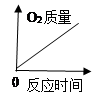 B .
B . 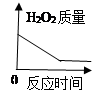 C .
C . 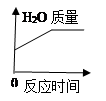 D .
D . 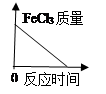
 B . 干燥NH3
B . 干燥NH3  C . 收集NH3
C . 收集NH3  D . 检验NH3
D . 检验NH3 
描述图1所示的木炭在氧气瓶中的燃烧现象:。

小组同学向石灰石中加入稀硫酸,实验一开始时,烧杯中出现了不少气泡,请写出该反应的化学方程式:。

小组同学将一定浓度的稀盐酸、稀硫酸分别加入装有等质量碳酸钙粉末的容器中,测得两者产生的二氧化碳体积(V)与反应时间(t)的关系如图3所示。



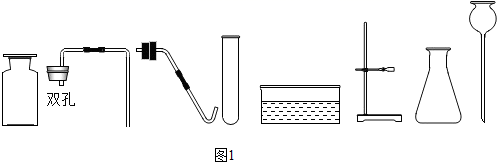
①仪器甲的名称是。
②写出实验室用A装置制取氧气的化学方程式。
③写出实验室用B装置制取二氧化碳气体的化学方程式;若用D装置收集二氧化碳(气体从c端进入),请将装置补画完整。
④若要制取并收集一瓶纯净干燥的二氧化碳气体,装置口连接顺序为a→→→→→。
⑤乙烯(C2H4)常用作“果实催熟剂”,它是一种无色无味、密度和空气接近、不溶于水的气体。若用图中的气体收集装置收集乙烯气体,应选用。
实验序号 | H2O2溶液的溶质质量分数% | 温度/℃ | MnO2粉末用量/g | 反应时间/s |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3 |
④ | 15 | 20 | 0.1 | 1 |
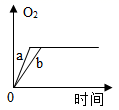
a.若要探究过氧化氢分解速率与温度的关系,则应做的实验是(填实验序号)。
b.对比实验③、④可得到的实验结论是什么?。
(进行实验)分别向三只试管中依次加入0.5gMnO2和30mL溶质质量分数不同的H2O2溶液,用温度传感器测定反应过程中溶液温度的变化,现象如下。
|
溶液 |
5%H2O2溶液 |
10%H2O2溶液 |
30%H2O2溶液 |
|
温度变化 |
| | |
| 水雾 | 有少量水雾 | 有较多水雾 | 有大量水雾 |
(解释与结论)
在MnO2作催化剂的条件下,H2O2发生分解反应的化学方程式为,该反应热量(填“吸收”或“放出”)。
(实验方案)
|
试验编号 |
H2O2溶液 |
蒸馏水 |
催化剂 |
温度/℃ |
|
|
溶质质量分数 |
I'/ mL |
I'/ mL |
|||
|
① |
10% |
10 |
20 |
无催化剂 |
20 |
|
② |
10% |
10 |
20 |
0.5gMnO2 |
20 |
|
③ |
10% |
15 |
x |
0.5gMnO2 |
20 |
对比实验①②,目的是探究与H2O2分解反应速率是否有关。
a 15 b 30
在恒温恒容的密闭容器中完成以上实验,用压强传感器测量反应过程中容器内的气体压强随时间的变化,实验数据如下图所示。
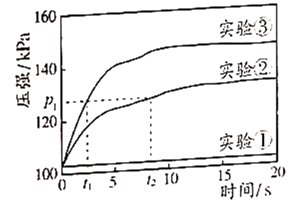
能证明溶质质量分数对H2O2分解反应速率有影响的证据是。



①从实验步骤中能体现氧气的密度比空气大的曲线是。
A.MN段 B.NP段 C.PQ段
②MN段和NP段相比较,说明。
③随着实验的进行,传感器测出氧气的体积分数约为时几乎不再变化。

装置A可证明气体中存在H2O,现象是。
实验前先通入一段时间氮气,再点燃E处酒精灯的目的是。

甲. ①→②→③ 乙. ②→①→③ 丙. ③→①→②
小红认为废液中溶质只有CaCl2 , 你认为还可能含有的溶质是(填化学式)。
CaCl2溶液呈中性。
【实验与结论】
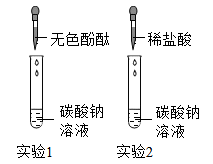
①小红取少量CaCl2溶液分别加入到2支试管中,并向其中分别滴入无色酚酞试液作对比实验,结果两试管中溶液均无色,于是小红认为自己的猜想是正确的。
②你认为小红的实验(填“能”或“不能”)证明他的猜想,理由是。
③如果要证明你的猜想是正确的,你选择的试剂是,实验中可以看到的现象是。
若实验证明你的猜想是正确的,想要处理废液只得到CaCl2溶液,应向废液中加入过量的石灰石,反应完成后进行(填一操作名称)。
猜想三:产物中含有。
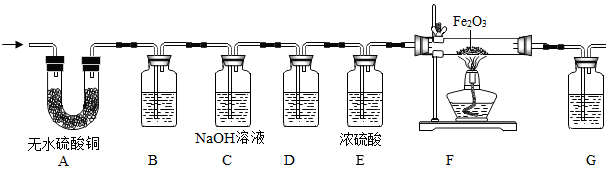
实验前,待,再点燃装置F中的酒精灯对固体进行加热。
【提出问题】
过氧化钠与水反应生成的气体是什么物质?
猜想Ⅰ:生成H2
猜想Ⅱ:生成O2
猜想Ⅲ:生成CO2
大家一致认为猜想Ⅲ不正确,理由是。
实验 | 实验现象 | 实验结论 |
用试管收集生成的气体,堵住试管口,移近酒精灯火焰,点燃 | 无明显现象 | |
用试管收集生成的气体,将带火星的木条伸入试管内 | 猜想Ⅱ成立 |
过氧化钠与水反应,除了产生气体,还有氢氧化钠生成。写出该反应的化学方程式:。
过氧化钠保存时应注意的问题是。
【查阅资料】维C泡腾片是一种较新的药物剂型,主要成分有:维C(C6H8O6)、碳酸氢钠(NaHCO3)、柠檬酸(C6H8O7)。维C泡腾片利用柠檬酸和碳酸氢钠反应做泡腾崩解剂、置入水中,即刻发生泡腾反应,生成大量的气体,状如沸腾,故名泡腾片。
【提出猜想】假设产生的气体可能是CO2、N2、O2
小明将气体通入中,观察到现象,证明该气体是CO2。
为了验证该反应是否遵循质量守恒定律,小明设计了如图所示的实验,实验前托盘天平的指针指向中间,反应结束后发现天平的指针偏,其原因是。由此他得出凡是有气体参与或生成的化学反应,在验证质量守恒时,反应装置应该在容器内进行。

小明继续查阅资料,得知:泡腾片在消毒剂上也有广泛的应用,其中二氧化氯泡腾片是其中一种消毒泡腾片。



①实验室制取二氧化碳的化学方程式是,发生装置和收集装置应选(选填“A至E字母”),若用F装置收集二氧化碳,二氧化碳应从(选填“①”、“②”)端进入。
②甲烷是密度小于空气、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物制取甲烷。制取甲烷的发生装置和收集较纯净甲烷应选(选填“A至E字母”)。
①探究氧气性质时,装置 G瓶底需铺一层水,目的是;写出反应的方程式。
②探究二氧化碳性质时,观察到装置 H 中现象是。


(提出问题)碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?


方案一:从定性观察角度判断
实验时装置A处的现象是。
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B+C(广口瓶+混合液) | m3 | m4 |
若猜想Ⅱ成立,则理论上(m4-m3)(m1-m2)(填“>”“<”或“=”)。



如果用装置⑨采用排空气法收集H2 , 则H2从导管口进入(填“a”或“b”)。
【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl;
猜想二:废液中的溶质可能是NaCl、Na2CO3;
猜想三:废液中的溶质可能是。
方案一:
|
实验操作与现象 |
化学方程式 |
实验结论 |
|
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生 |
|
猜想二正确 |
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。
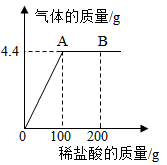
①产生CO2的质量为g。
②滴入稀盐酸至恰好完全反应时,所得溶液中溶质的质量分数是多少?
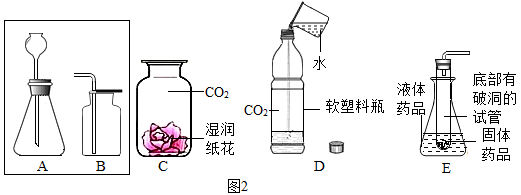
①请连接A和B,将制取装置图补充完整:,反应的化学方程式为,C中的实验现象是。
②D是向装满的软塑料瓶注入约
瓶体积的水,立即旋紧瓶盖,振荡,观察到的现象是。

①所选仪器的连接顺序为(从左到右填写仪器序号字母)。
②上述制氢气的化学方程式为。
③锌和稀硫酸反应过程中,溶液的pH将(填“增大”“减小”“不变”之一)。
①装置 A 中所发生反应的化学方程式为。
②装置 B 的作用是。
③按装置进行实验,在实验过程中,B2、C 质量均增加,D 无明显现象,说明塑料袋试样为。(填“聚乙烯”“聚氯乙烯”之一)。
④W g 该塑料试样充分燃烧后,测得仪器 C 质量增加 a g,则该塑料袋试样中含碳元素的质量为g(计算结果用含字母的代数式表示)。
⑤若实验中使用的氧气未干燥,这样测算出的塑料袋试样中碳元素与氢元素的质量比与实际值比较将(填“偏大”“偏小”“基本一致”“无法确定”之一)。
【提出问题】如何选择药品和设计装置进行测定?
【查阅资料】蛋壳的主要成分是CaCO3 , 其它成分对实验的影响忽略不计。
【进行实验】
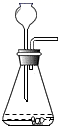
将蛋壳洗净、干燥、并捣碎后放入图①锥形瓶中,通过注射器加入稀盐酸,采集数据。

图①锥形瓶中反应的化学方程式为。

图③装置中连通管的作用是:,若无“植物油”,测定的碳酸钙含量(填“偏大”“偏小”或“不变”)。

该实验中反应前后均需通一段时间氮气,反应后通入氮气的目的是。
图④中,通过称量反应前后装置(填字母序号)的质量可达到实验三的目的。


A给试管中的液体加热;
B向试管中倾倒液体;
C将块状固体放入试管中。