 用方案甲探究同种物质在不同溶剂中的溶解性
B .
用方案甲探究同种物质在不同溶剂中的溶解性
B .  用方案乙探究空气是铁生锈的必要条件
C .
用方案乙探究空气是铁生锈的必要条件
C .  用方案丙探究不同催化剂对H2O2分解速率的影响
D .
用方案丙探究不同催化剂对H2O2分解速率的影响
D .  用方案丁探究合金及其成分金属的熔点高低
用方案丁探究合金及其成分金属的熔点高低
实验一:取少量样品于试管中,滴加1~2滴酚酞溶液,溶液显红色。
实验二:取少量样品于试管中,加入适量稀硫酸,有气泡放出。
实验三:取少量样品于试管中,加入足量的BaCl2溶液,有白色沉淀生成。过滤,向滤液中滴加1~2滴酚酞溶液,溶液显红色。
下列结论正确的是( )


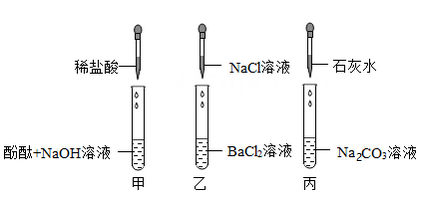
【提出问题】小烧杯中上层溶液的溶质成分有哪些?
【做出猜想】猜想一:NaCl、NaOH、Na2CO3
猜想二:NaCl、NaOH
猜想三:
|
实验步骤 |
实验现象 |
实验结论 |
|
取少量溶液于试管中,滴加过量稀盐酸 |
① |
猜想一不成立 |
|
另取少量溶液于试管中,滴加少量② |
③ |
猜想三成立 |
小烧杯中的白色沉淀成分是(写化学式)。


同学们接着对C中产生的白色不溶物的成分进行了以下探究。
C中产生的白色不溶物是什么呢?
【查阅资料】
①Mg(OH)2和MgCO3均为白色不溶物。
②Mg(OH)2和MgCO3均可与盐酸发生复分解反应。
③Mg(OH)2和MgCO3加热均易分解,分别生成两种氧化物。
④Mg(HCO3)2可溶于水,且不稳定,易分解为MgCO3、H2O、CO2。
⑤白色的无水硫酸铜遇水会变成蓝色。
【提出猜想】
猜想一:白色不溶物是纯净的Mg(OH)2。
猜想二:白色不溶物是纯净的 。
猜想三:白色不溶物是Mg(OH)2、MgCO3的混合物。
取该白色不溶物加足量的稀盐酸,发现不溶物全部溶解,并有气体产生,则猜想 不成立。再取干燥的该白色不溶物加热分解,并将所产生的气体通过无水硫酸铜,发现无水硫酸铜变蓝,由这两个小实验得出猜想 成立。
如图Ⅱ,称取干燥的该白色不溶物70.4克于热分解装置中,充分加热至不再产生气体,使分解产生的气体依次通过装置D、E,并使分解产生的气体全部被装置D、E吸收,实验后测得装置D增重3.6克,装置E增重30.8克,若该白色不溶物的组成用xMg(OH)2•yMgCO3表示,则x:y=。
【查阅资料】
鸡蛋膜有极其微小的孔隙。
如图所示:向5个鸡蛋壳内分别加入下表中的物质,放入盛有蒸馏水的小烧杯中,一段时间后取出鸡蛋壳,再向小烧杯中分别加入下表中的物质进行实验。

|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
鸡蛋壳内加入的物质 |
NaCl溶液 |
Na2CO3溶液 |
NaOH溶液 |
淀粉溶液 |
鸡蛋清 |
|
小烧杯中加入的物质 |
AgNO3溶液 |
CaCl2溶液 |
FeCl3溶液 |
碘水 |
浓硝酸 |
|
小烧杯中的现象 |
白色沉淀 |
|
红褐色沉淀 |
无现象 |
无现象 |
实验①小烧杯中产生的白色沉淀是;实验③小烧杯中产生红褐色沉淀,反应的化学方程式为。
综上实验探究可知:构成物质的基本粒子的体积。
小明同学认为上述实验④⑤不能比较分子体积大小差异,还应增加下列对比实验进行完善:将实验④鸡蛋壳内和小烧杯中物质互换,重复上述实验操作,小烧杯中的现象是。
【拓展延伸】
科学家设计制造出孔径大小不同的“小筛子”,让体积大小不同的粒子通过,从而分离提纯物质。如天然水的净化、海水淡化。
小可认为该溶液中溶质是NaOH:
小琳认为该溶液中溶质是Na2CO3:
小明却认为该溶液中溶质是(填化学式)。
【进行实验】
实验 | 实验操作 | 实验现象 |
① | 小可取适量该溶液,滴入几滴无色酚酞溶液 | 溶液变红色 |
② | 小琳取适量该溶液,滴入几滴氯化钡溶液 | 产生白色沉淀 |
③ | 小明取适量该溶液,滴入过量氯化钡溶液 | 产生白色沉淀 |
④ | 小明取适量实验③所得的上层清液,滴入几滴无色酚酞溶液 | 溶液变红色 |
【实验结论】
①根据实验①和②可以得出结论:该溶液中一定含有的溶质是(填化学式)。同学的猜想一定是错误的。原因是。
②根据实验③和④。你认为小明同学的猜想(填“正确”或“不正确”)。
①氢氧化钠溶液变质的原因是(用化学方程式表示)。
②实验室为了防止氢氧化钠溶液变质,正确的措施是(写出一条即可)。
【查阅资料】蛭石是一种耐高温的超级保温材料,难溶于水,不与硫酸铜溶液反应。
【进行实验】分别取2勺铁粉和活性炭,加入无纺布袋中(与市售暖足贴所用无纺布相同),滴加少量氯化钠溶液,混合均匀制得暖足贴。在相同环境下,利用温度传感器测定自制与市售暖足贴温度随时间的变化,形成图像,如图所示。

通过图像可知自制暖足贴有两点不足,分别是、。
【方案设计】利用市售暖足贴中的全部粉末,设计如下方案。

①设计步骤Ⅰ、Ⅱ的目的是。固体B的成分是。
②根据上述方案,确定蛭石质量需要的称量数据最少的一组是。
久置的氢氧化钠固体的成分有下面3种可能情况:
猜想一:只有氢氧化钠
猜想二:
猜想三:只有碳酸钠
实验方案 | 实验现象 | 结论 |
称取m克固体放入试管中,加蒸馏水完全溶解,然后滴加足量的BaCl2溶液 | 猜想一不成立 |
为了进一步验证是猜想二还是猜想三成立,活动小组的同学们又提出了一个定量实验方案。实验如下:将反应后的物质过滤、洗涤、干燥,称得沉淀的质量为ng(忽略操作过程中物质 的损失)。若猜想二成立,则n的取值范围是。
氢氧化钠暴露在空气中容易变质,其主要原因是(用化学方程式表示),因此实验室中氢氧化钠固体必须密封保存。
Ⅰ、制碱石灰的流程:
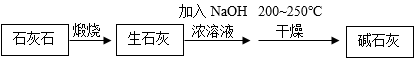
Ⅱ、Ca(OH)2的分解温度是580℃;NaOH受热不分解。
煅烧石灰石发生反应的化学方程式是。
【作出猜想】样品中的成分可能有下列几种:
猜想1:Ca(OH)2、NaOH
猜想2:CaCO3、Ca(OH)2、NaOH
猜想3:CaCO3、NaOH、Na2CO3
猜想4:CaCO3、Na2CO3
【实验探究】该小组同学设计并进行了如下实验(已知BaCl2溶液呈中性)。
|
实验步骤 |
现象 |
结论 |
|
①取5 g“碱石灰”样品于烧杯中,加入50 g水,充分搅拌后,静置 |
烧杯底部有白色固体 |
猜想1不正确 |
|
②取①烧杯中上层清液少许,加入试剂X |
无明显现象 |
猜想2不正确 |
|
③取①烧杯中上层清液少许,滴2滴酚酞溶液 |
溶液变红 |
猜想3正确,而猜想4不正确 |
|
④取③变红的溶液,加入过量BaCl2溶液 |
|
实验①方案不严密,理由是。
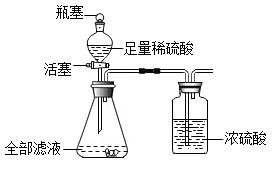
实验记录如下表。
|
滤渣质量 |
活塞关闭时整个装置总质量(仪器+药品) |
打开瓶塞和活塞反应完成后整个装置总质量(仪器+药品) |
|
8.00 g |
442.64g |
442.20g |
【结论与评价】
根据数据可计算原样品中各成分的含量,其中NaOH的质量分数是。
他们继续向溶液M中滴加碳酸钠溶液,发现只有白色沉淀产生,无其它实验现象。由此可知,溶液M中除了含有酚酞外,还含有的溶质是(填化学式)。
【猜想与假设】甲同学猜想:NaCl、BaCl2
乙同学猜想:NaCl
丙同学猜想:NaCl、Na2CO3
【分析与交流】上述猜想中不合理是同学的猜想。甲同学猜想溶液N中含有NaCl的依据是(用化学方程式表示)。

【猜想假设】同学们猜想该固体有CaO、Ca(OH)2中的一种或两种。你认为还可能有。
【实验验证】
|
序号 |
实验操作 |
实验现象 |
实验结论 |
|
实验1 |
取样品于试管中,加水溶解,用手触摸试管外壁。 |
试管外壁, 试管底部有白色固体 |
样品中一定含有CaO |
|
实验2 |
将实验1中液体过滤,取少量滤液于试管中,向其中通入气体。 |
滤液变浑浊 |
样品中一定含有Ca(OH)2 |
|
实验3 |
取少量实验2中的滤渣,加入足量的稀盐酸。 |
|
样品中含有你猜想的物质 |
①若证明实验2滤液中Ca(OH)2的存在,选用下列物质中的(填字母)也可达到实验目的。
A.稀硝酸 B.酚酞溶液 C.碳酸钠溶液
②实验室中,易与空气中某些物质反应的药品更要保存。
近年来,自热食品种类繁多。只需将撕去塑料膜的发热包放入凉水中,就能享用美食,很受年轻人的追捧。实验小组同学买来一份自热食品进行以下探究。
【资料】Ⅰ、发热包中物质的主要成分是生石灰、碳酸钠、铝粒。
Ⅱ、铝能和NaOH溶液反应生成偏铝酸钠(NaAlO2)和氢气,偏铝酸钠溶于水。
小组同学取出发热包,撕去塑料膜,放入适量凉水中,可观察到的现象是,固体迅速膨胀,同时还可观察到发热包内固体变硬结块,其可能的原因是(用化学方程式表示)。
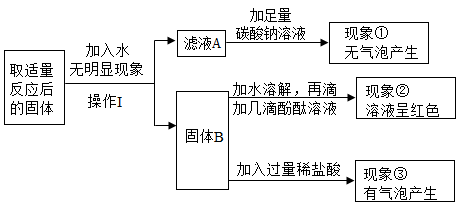
根据以上操作和实验现象回答下列问题。
操作Ⅰ的名称是。
小吴按照说明书将适量茶垢清洁剂放入有茶垢的杯子中,加入热水浸没茶垢,立即产生大量气泡,一段时间后冲洗茶杯,茶杯光亮如新。
【查阅资料】茶垢清洁剂的主要成分为过碳酸钠(Na2CO4)。
【猜想与假设】同学们对该气体的成分提出了三种猜想。
猜想1:只有O2;猜想2:;猜想3:既有O2又有CO2。
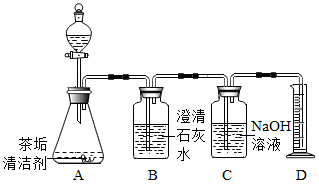
操作 | 现象 | 结论 |
检查气密性后,向A中加入热水,将生成的气体依次通过B、C,向D中插入带火星的木条。 | 观察到B中,D中木条复燃。 | 猜想1正确。 |
【猜想与假设】同学们查阅资料后,作出三种猜想。
猜想1:只有Na2CO3;
猜想2:只有NaOH;
猜想3:既有Na2CO3又有NaOH。
【实验验证】小施从下列试剂中选择合适的试剂完成探究:稀盐酸、饱和Ca(OH)2溶液、CaCl2溶液、酚酞溶液、Ba(OH)2溶液。
操作 | 现象 | 结论 |
步骤1:取少量溶液E,滴加。 | 有气泡产生 | 溶液中一定有 Na2CO3 , 猜想2不正确。 |
步骤2:另取少量溶液E,滴加CaCl2溶液至不再产生沉淀为止,向上层清液中加入。 | 无明显现象 | 溶液中无NaOH,猜想3不正确,猜想1正确。 |
①根据过碳酸钠的性质,保存茶垢清洁剂应注意。
②过氧化钠(Na2O2)常用作供氧剂,其与水反应的历程与过碳酸钠类似,即先与水反应生成过氧化氢和一种碱,之后过氧化氢迅速分解。请写出过氧化钠与水反应的总反应方程式。
【实验探究1】用pH试纸测得等浓度的碳酸氢钠溶液的pH为9,碳酸钠溶液的pH为11。
【实验结论1】两者均显碱性,且溶液碱性较强的是 。
【实验探究2】向盛有碳酸钠溶液的烧杯中,逐滴加入一定浓度的稀盐酸并充分搅拌,测得pH变化与时间的关系如图1所示。观察到ab段无气泡产生,从b点开始产生气泡。经测定b点溶质只有碳酸氢钠和氯化钠,c点pH为7。

【实验结论2】碳酸钠和盐酸的反应是分两步发生的,ab段发生反应的化学方程式为 ,c点溶液中的溶质为 。
【查阅资料】①碳酸氢钠受热分解成碳酸钠、水和二氧化碳;②碳酸钠受热不分解。
【实验验证】取一定量的碳酸氢钠放入试管中加热,如图2所示。

【交流反思】试管A管口向下倾斜的原因是 ,试管B中出现 现象,证明有二氧化碳生成。
【实验结论3】碳酸钠的热稳定性强于碳酸氢钠。
【提出问题】兴趣小组在研究溶洞成因后提出:
在碳酸钠溶液中通入二氧化碳气体也会发生类似的反应吗?
推测反应方程式为:Na2CO3+H2O+CO2=2NaHCO3
猜想一:碳酸钠、二氧化碳和水会发生反应。
猜想二:。
②碳酸钠与碳酸氢钠相互不反应。
【实验方案设计】
第一步:制备检测样品。向盛有Na2CO3溶液的烧杯中通入一定量的二氧化碳后,通过系列的操作制得了固体,并干燥固体待用。
第二步:将第一步制得的固体加热,以检验固体中是否有碳酸氢钠。

实验装置如图一所示,在加药品前应先检查装置。
完成上述操作后,将固体样品放入试管并加热。
同学们在大试管里放碳酸钠(直接受热),小试管里放碳酸氢钠(间接受热)。一段时间后,出现(选填下列选项中编号)的现象,则证明碳酸氢钠受热分解,碳酸钠受热不分解。由此推出图一装置产生的二氧化碳来自于碳酸氢钠的分解。
A.烧杯A中澄清石灰水变浑浊,烧杯B中澄清石灰水不变浑浊
B.烧杯A中澄清石灰水不变浑浊,烧杯B中澄清石灰水变浑浊
C.烧杯A和烧杯B中澄清石灰水均变浑浊
D.烧杯A和烧杯B中澄清石灰水均不变浑浊
【探究结论】碳酸钠、二氧化碳和水会发生反应。
【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是: , 然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】杂质为碳酸钠和氯化钠。
【实验探究】①甲同学取样溶于水,向溶液中滴加酚酞溶液,观察到液体变红色,认为杂质中含有碳酸钠。乙同学认为甲同学的实验不足以证明杂质中含有碳酸钠,理由是。
②乙同学重新设计实验如下:
实验操作 | 实验现象 | 实验结论 |
步骤a:取样溶于水,向溶液中滴加过量稀硝酸 | 杂质中含有碳酸钠 | |
步骤b:向a所得溶液中继续滴加硝酸银溶液 | 有白色沉淀产生 | 杂质中含有 |
【提出问题一】呼出的气体中有哪些物质与过氧化钠(Na2O2)发生反应,且生成物是什么?
【查阅资料】
①呼出的气体主要含有氮气、二氧化碳、水蒸气和氧气
②过氧化钠与氮气、氧气不反应
③过氧化钠为淡黄色固体粉末
步骤一 | 步骤二 | 步骤三 | |
实验操作 |
|
|
|
实验现象 | 有气泡产生 | 带火星的木条复燃 | 出现 |
实验结论 | H2O能'与Na2O2反应,产生氧气和NaOH | ||
步骤一 | 步骤二 | |
实验操作 |
|
|
实验现象 | 淡黄色粉末逐渐变成白色粉末,带火星的木条复燃 | 固体溶解出现 |
实验结论 | CO2能与Na2O2反应,产生氧气和Na2CO3 | |
【作出猜想】根据人体呼出的气体中含有较多的 CO2和 H2O。对剩余固体的成分做出如下猜想:
猜想 1:只有氢氧化钠;
猜想 2:;
猜想 3:含有氢氧化钠和碳酸钠。
实验操作 | 实验现象 | 实验结论 |
①取少量剩余固体溶于水后,加入过量的 CaCl2溶液 | 含有 Na2CO3 | |
②将上述反应后的混合物过滤,取滤液滴加溶液 | 产生白色沉淀 |
【得出结论】猜想 3 成立。
①操作①中加入过量的 CaCl2溶液的目的是。
②操作①中能代替 CaCl2溶液的试剂是(写填字母)。
A.NaCl 溶液 B.Ca(NO3)2溶液 C.BaCl2溶液
③“氧气再生剂”应保存。
实验操作 | 现象 | 结论 |
取样品加水溶解,加入过量稀盐酸至反应完全 | 有产生 | 样品中有NaCl |
向上述溶液中继续滴加适量AgNO3溶液 | 有产生 |
有同学认为该实验方案有不正确,正确方案应选用(填字母)代替稀盐酸。
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
【方案1】将样品溶解,加入过量CaCl2溶液,搅拌至反应完全。该反应的化学方程式为。过滤、洗涤、干燥,称量沉淀的质量,计算Na2CO3的质量分数。
【讨论】上述两个方案中,你认为方案更优。

a.40-10 b.60-30 c.70-40
①“问天”小组的猜想是:该溶液没有变质。
②“梦天”小组的猜想是:该溶液部分变质。
③“天和”小组的猜想是:该溶液全部变质。
三个小组的同学们根据各自猜想,分别进行如下实验:
小组名称 | “问天”小组 | “梦天”小组 | “天和”小组 |
药品种类 | 酸 | 碱 | 盐 |
实验操作 |
|
|
|
实验现象 | 有生成 | 有白色沉淀生成溶液颜色变红 | 有白色沉淀生成溶液颜色不变色 |
实验结论 | 该溶液已经变质 | 该溶液部分变质 | 该溶液 |
“问天”小组的实验中,能证明该溶液已经变质的化学方程式为。
①在不改变被检验物质成分的情况下,排除干扰,能帮助我们得出正确结论。
②“失之毫厘,差以千里。”科学探究要有严谨的科学态度。
【拓展与延伸】
经过以上探究活动,同学们认为取用药品后,应及时瓶塞,防止药品变质。
对于同学们发现的这瓶溶液,下列处理方法中正确的是____。
【实验方案】
①取少量土壤样品,加蒸馏水充分搅拌,静置澄清后过滤;
②用玻璃棒蘸取少量滤液滴在pH试纸上,等试纸显色后与对比,读出pH,进一步确定土壤酸碱性。
|
|
滤液1 |
滤液2 |
滤液3 |
滤液4 |
|
测得的pH |
5 |
6 |
6 |
5 |
【实验结论】该土地的土壤呈性。
【调查分析】经调查,该土地之前的承包者为使自己种植的农作物生长茂盛,施用了大量化肥——硫酸铵,于是推测土壤的酸碱性出现问题的原因是土壤中含有大量的硫酸铵。
【设计实验】
|
实验步骤 |
实验现象 |
实验结论 |
|
步骤①:取“活动一”中的滤液于试管中,滴加溶液 |
有生成 |
土壤中含有硫酸根离子 |
|
步骤②:另取适量土壤样品,加熟石灰混合研磨 |
有刺激性气味的气体产生 |
土壤中含有离子 |
|
|
所用物质 |
改良原理 |
|
改良酸性土壤 |
熟石灰[Ca(OH)2] |
氢氧化钙能与土壤中的酸性物质反应 |
|
草木灰(主要成分为K2CO3) |
|
|
|
改良碱性土壤 |
硫酸亚铁(FeSO4) |
硫酸亚铁能与土壤中的碱性物质反应 |
【得出结论】兴趣小组的同学们通过分析确定用草木灰改良该土壤。
【提出问题】氢氧化钠溶液是否变质及变质的程度?
【猜想与假设】①没有变质:②部分变质:③全部变质。
【实验与结论】
方案 | 实验操作 | 现象 | 结论 |
方案一 | 取该溶液2mL于试管中,滴入少量稀盐酸 | 无明显现象 | 没有变质 |
方案二 | 首先取该溶液2mL于试管中,滴入过量氯化钡溶液 | 溶液变浑浊 | 部分变质 |
静置,然后取上层清液放入试管中,滴入硫酸铜溶液 | 有蓝色沉淀产生 |
实验结束后,小组同学对两种方案得出的结论不同进行了充分讨论:一致认为方案二科学合理,方案一有明显漏洞,你认为方案一的漏洞导致结论错误的原因是;
该氢氧化钠溶液变质的原因是(用化学方程式表示),因此需保存。
【查阅资料】
①干粉灭火器的主要成分为NaHCO3。
②NaHCO3受热分解生成Na2CO3、二氧化碳和水;Na2CO3受热不分解。
③NaHCO3溶液呈碱性,且不与BaCl2溶液发生反应。
猜想一:固体成分为NaHCO3;
猜想二:固体成分为;
猜想三:固体成分为NaHCO3和Na2CO3。
实验步骤 | 实验现象 | 实验结论 |
小东同学取少量白色固体于试管中,加水溶解,再滴入无色酚酞溶液 | 无色酚酞溶液变红 | 猜想一成立 |
【提出质疑】小玫认为小东得出的结论不准确,理由是。
实验步骤 | 实验现象 | 实验结论 |
①。 | 澄清石灰水变浑浊 | 固体中含有 NaHCO3 |
②另取少量白色固体于试管中,加水使之完全溶解,再滴加BaCl2溶液。 | 发生反应的化学方程式为 ; 固体中含有Na2CO3 |
【实验结论】猜想三正确。
【猜想与假设】样品的成分可能是Ca(OH)2和CaCO3中的一种或两种。
【查阅资料】20℃时溶解度:Ca(OH)2—0.161g,CaCO3—0.005g。
【设计实验】学习小组设计如下实验进行探究。
编号 | 实验操作 | 实验现象 | 实验结论 |
① | 取样品于烧杯中,加入一定量的水溶解 | 温度无变化,烧杯底有白色固体 | 有CaCO3 |
② | 将①中液体过滤,取少量滤液于试管中,滴入1~2滴酚酞试液 | 溶液变红 | 有Ca(OH)2 |
③ | 有气泡产生 | 有CaCO3 |
Ca(OH)2微溶于水,实验①结论不完全正确,实验②和实验③结论正确。请你完善实验③的实验操作。
学习小组用熟石灰进一步研究酸碱中和的性质,如图1,取少量熟石灰于烧杯中,加适量的水充分搅拌后,熟石灰未完全溶解,在烧杯中连接pH传感器,然后缓慢滴入稀盐酸,并不断搅拌,熟石灰逐渐溶解。pH传感器数据曲线如图2,请从微观角度分析a~b段变化实质:。
“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。
纯碱属于(填“酸”“碱”或“盐”)。
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH-。
②Na2CO3在水中全部解离出Na+和。
③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
【提出猜想】猜想一:H2O单独起作用,产生较多的OH- , 使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH- , 使溶液呈碱性。
猜想三:。
实验操作 | 实验现象 | 实验结论 |
①向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液 | 溶液无明显变化 | 猜想一不成立 |
②向试管中加入一定量的NaCl溶液,滴入2滴酚酞溶液 | 溶液无明显变化 | 猜想二不成立 |
③①向试管中加入一定量的Na2CO3溶液,滴入2滴酚酞溶液 ②往①所得溶液中逐滴加入CaCl2溶液至过量 | ①溶液由无色变红色 ② | 猜想三成立 |
【拓展与延伸】结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:Na2CO3溶液中含有的阴离子是。
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
溶液温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 70 |
溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
【解释与结论】
①实验①、②、③对比,可得出的结论是。
②要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是。
请写出第一步反应的化学方程式:。
方案1:收6.00g干燥样品放入图中硬质玻璃管中加热,充分反应后测得装置C增重0.27g,装置D增重1.32g。

装置A和D中盛放的药品应选择:A,D(填序号)。
①碱石灰 ②浓硫酸 ③氯化钙 ④无水硫酸铜
方案2:向一定质量的干燥样品中加入足量稀硫酸,通过测定产生CO2气体体积和反应后剩余固体的质量来确定其组成,装置如图所示。

①先使量气装置两侧液面相平,再恢复至室温
②先恢复至室温,再使量气装置两侧液面相平
【查阅资料】影响化学反应速率的因素有很多,如:使用催化剂、改变温度、改变反应物的浓度等。
【实验探究】小组的同学们按图组装,在室温下分别进行了四组实验,并用O2传感器测定实验过程中O2含量的变化情况,得到如下图所示曲线。
组别 | 试剂 |
第1组 | 2mL 5% H2O2 |
第2组 | 2mL 5% H2O2 + 3滴FeCl3溶液 |
第3组 | 2mL 5% H2O2 + 3滴CuSO4溶液 |
第4组 | 2mL 5% H2O2 +少量MnO2粉末 |


【实验结论】对比四条曲线,进行分析:
温度 H2O2% | 50℃ | 60℃ | 70℃ |
5% | 无明显气泡 | 无明显气泡 | 极少量气泡 |
10% | 无明显气泡 | 无明显气泡 | 少量气泡 |
15% | 无明显气泡 | 少量气泡 | 较多气泡 |
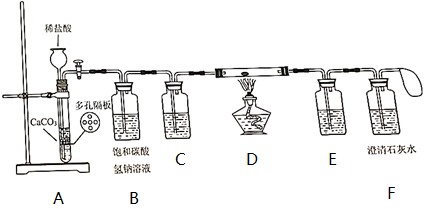
【查阅资料】
①Na是一种银白色金属,化学性质很活泼,常温下可与O2、H2O等物质发生反应,加热条件下与O2反应生成较复杂的氧化物。
②Na2O为白色固体,溶于水并与H2O反应生成NaOH,还能与CO2反应生成Na2CO3。
【实验过程】
③打开活塞,向长颈漏斗中加入适量盐酸,让产生的气体依次通过后面装置。
④待F中石灰水变浑浊,点燃酒精灯加热,金属钠熔化并开始燃烧,熄灭酒精灯,待钠燃烧完全且试管冷却后再关闭活塞,观察产物为白色固体。
①实验过程中为什么要先通一会CO2再点燃酒精灯而不是直接点燃酒精灯?。
②C和E装置中盛放的试剂都是(填试剂名称);B装置的作用是。
【进行猜想】
猜想一:只有Na2O;猜想二:只有Na2CO3;猜想三:既有Na2O又有Na2CO3
【实验探究】为验证猜想,小组同学设计如下实验,请填写表格中空白处。
实验 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将固体样品溶于水,取溶液少许于试管中,向其中滴加过量盐酸,观察现象。 | 猜想一不正确 | |
Ⅱ | 再取样品溶液少许于试管中,先向其中滴加过量BaCl2溶液(BaCl2溶液呈中性),待沉淀完全后静置,再取上层清液少许于试管中,滴入几滴无色酚酞溶液,观察现象。 | 溶液变红 | 猜想正确 |
小组有同学提出将实验Ⅱ中的无色酚酞溶液改成MgCl2溶液也可验证相同的猜想,请写出相应的实验现象:。
【实验探究】小明家中有久置的食品干燥剂(主要成分为生石灰)和消毒用双氧水(过氧化氢溶液),为探究能否继续使用,在老师指导下,他与同学们在实验室探究如下:
食品干燥剂 | 消毒用双氧水 | |
操作 | 取样于烧杯中,加适量水 | 取样于烧杯中,加适量二氧化锰 |
现象 | 没有气泡产生 | |
结论 | 还能继续使用 |
反思与交流:久置的双氧水可能失效,反应的化学方程式为。
【实验探究】化学小组在实验过程中,部分记录如下表:
加了酚酞的氢氧化钠溶液 | 碳酸钠溶液 | 硝酸钡溶液 | |
滴加稀硫酸 | 溶液呈红色 | 产生气泡 | 产生白色沉淀 |
反思与交流:
①有白色沉淀生成的反应化学方程式为。
②甲同学认为硫酸与氢氧化钠没有发生反应,其理由是;乙同学认为它们发生了反应,只需从“试剂用量”角度作实验改进即可证明,其方法是。
步骤 | Ⅰ | Ⅱ | Ⅲ | IV |
方法 | 将三组废液倒入同一烧杯中 | 静置 | 滴加足量的硫酸钠溶液 | 加过量的X |
现象 | 浑浊,产生气泡,红色消失 | 分层 | 无明显现象 | …… |
反思与交流:
①步骤Ⅱ静置后的上层清液中,除酚酞外一定含有的溶质是(填化学式,下同):溶质种类最多时,溶质有。
②步骤Ⅳ加过量X的目的用化学方程式可表示为。
【提出猜想】猜想一:该气体是CO2;猜想二:该气体是SO2;猜想三:该气体是。
①SO2能与酸性高锰酸钾溶液反应,使其褪色。
②
【实验设计】

【现象与分析】
①装置B中酸性高锰酸钾溶液颜色变浅,说明气体中含有。装置B中高锰酸钾溶液必须足量的原因是。
②装置C中澄清石灰水变浑浊,说明气体中含有CO2 , 请写出反应的化学方程式。
【实验结论】猜想三成立。
若装置B与装置C位置互换,该实验设计是否合理,理由是。

①仪器A的名称是。
②从上图中选择合适的仪器组装一套CO2发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些?(填标号)
序号 | 反应物 | 收集每瓶气体所用时间(单位:秒) | |||||||
盐酸 浓度 | 盐酸 体积 | 大理石 形状 | 第1瓶 | 第2瓶 | 第3瓶 | 第4瓶 | 第5瓶 | 第6瓶 | |
实验1 | 10% | 70mL | 小颗粒 | 8 | 9 | 10 | 12 | 14 | 19 |
实验2 | 块状 | 11 | 12 | 15 | 17 | 21 | 23 | ||
实验3 | 7.5% | 70mL | 小颗粒 | 10 | 12 | 13 | 15 | 17 | 26 |
实验4 | 块状 | t | 14 | 16 | 19 | 22 | 24 | ||
实验5 | 5% | 70mL | 小颗粒 | 14 | 18 | 19 | 32 | 63 | — |
实验6 | 块状 | 20 | 31 | 59 | — | — | — | ||
①该小组研究了哪些因素对反应快慢的影响?
②为了分析浓度对反应快慢的影响,可对比表中实验(填标号)。
A.2和3 B.2和4 C.4和5 D.1和6
③根据实验数据反映出的规律,表中数值t的合理范围是:<t<。
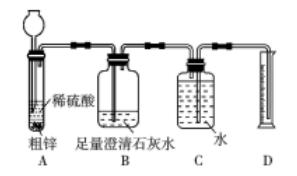
回答下列问题:
①写出制备CO2的化学方程式。
②推测废液所含溶质
推测一: 推测二:CaCl2和HCl
③若要用一种药品验证哪种推测成立,可选择的有哪些?(填标号)
A.石蕊溶液 B.AgNO3溶液 C.锌粒 D.CuO粉末
实验表明废液中的溶质是CaCl2和HCl,小组决定用Na2CO3除去它们。
【提出问题】如何估算Na2CO3固体的用量?
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。

【结果讨论】
①a→b阶段,观察到烧杯中的现象是。
②b点后曲线平缓阶段,反应的化学方程式为。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积120mL。(填“大于”“等于”或“小于”)
④将烧杯中的沉淀过滤、干燥、称重,质量为4g。若处理10L该废液,理论上需要Na2CO3固体g。(实验所用Na2CO3溶液的密度近似看做1g/cm3)

①用图中仪器完成实验,还缺少的玻璃仪器是(填名称),玻璃棒在配制实验中的作用是。
②配制该溶液需要g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数10%。(填“大于”或“小于”)
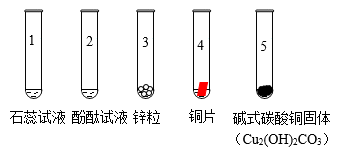
①中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn(填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为。
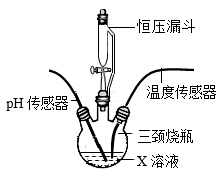
①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是,实验进行到60s时溶液中的溶质为(填化学式)。

②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中能量的结论(填“吸收”或“释放”)。
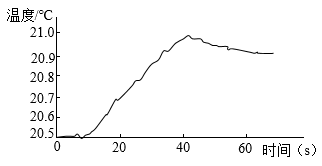
③丙同学提出,通过监测三颈烧瓶内压强变化,也可以推导出乙同学的实验结论,其理由是。
【查阅资料】
a、发热包内的粉末主要由生石灰、铁粉、铝粉、碳粉、氯化钠等组成;
b、铝是一种两性金属,与强酸、强碱溶液反应都能生成H2;
c、AgCl是既不溶于水又不溶于酸的白色沉淀。
|
步骤 |
实验操作 |
实验现象 |
实验结论 |
|
一 |
取部分粉末,将磁铁靠近 |
发现有黑色物质被磁铁吸引 |
成分中有 |
|
二 |
将磁铁充分吸附后的剩余粉末分成两份,其中一份加水溶解,过滤,取滤液测pH |
pH试纸变蓝紫色 |
pH 7成分中有生石灰 |
|
三 |
取少量滤液于试管中,先加入过量稀硝酸,再加入少量溶液 |
生成白色沉淀 |
成分中有 |
|
四 |
将另一份粉末放入烧杯,加入适量NaOH溶液 |
|
成分中有铝粉 |
|
五 |
将步骤二中过滤得到的滤渣放入硬质玻璃管中,将产生的气体通入澄清石灰水 |
石灰水变浑浊 |
成分中有碳粉 |
【查阅资料】①Ag2O和粉末状的Ag均为黑色固体
②
③Ag2O可溶于氨水:Ag2O与稀硝酸反应生成AgNO3和H2O
④Ag不溶于氨水:
【猜想与假设】猜想一:只有Ag 猜想二:只有。猜想三:有Ag、Ag2O
实验操作 | 实验现象 | 实验结论 |
取适量黑色固体,加入足量(填一种试剂),振荡 | 猜想一成立 |
分别取等质量的白色颗粒和等体积的水加入a、b两支试管,再向b试管中加入黑色粉末。观察到a试管仅有少量气泡,b试管有大量气泡。

①黑色粉末起作用。
②欲使a试管产生气泡加快,可加入 (填序号)。
A.CuSO4溶液 B.NaCl溶液 C.MnO2
根据元素守恒,上述反应后溶液中溶质的成分可能为:
①只含NaOH ②只含Na2CO3③NaOH和Na2CO3的混合物……
甲、乙两同学仅针对前三种可能性,分别设计实验1和实验2进行验证。
序号 | 操作和现象 | 实验结论 |
实验1 | 取b试管上层清液滴加过量稀盐酸,产生能使澄清石灰水变浑浊的气体 | 只含Na2CO3 |
实验2 | 第一步:取b试管上层清液滴加过量CaCl2溶液,产生白色沉淀并过滤 第二步:在滤液中滴加酚酞,溶液(填现象) | 只含Na2CO3 |
丙同学认为实验1的结论不严谨,理由是。
结合实验现象,该制氧机的制气原理有两步反应,写出第二步的化学方程式:
①2Na2CO3●3H2O22Na2CO3+3H2O2;
②
制氧机制氧选择过碳酸钠而不选择双氧水的根本原因是(填序号)。A.产物无污染 B.制取成本更低 C.运输储存更方便
【提出问题】
如何测定草木灰中碳酸钾的含量?
【查阅资料】
1 常见草木灰钾含量(以碳酸钾表示)如下表:
草木灰种类 | 小灌木灰 | 稻草灰 | 小麦杆灰 | 棉壳灰 | 棉秆灰 | 向日葵杆灰 |
K2CO3(%) | 8.66 | 2.63 | 20.26 | 32.28 | 16.44 | 51.97 |
2 提取碳酸钾主要过程是:秸秆→草木灰→滤液→固体
实验一:提取碳酸钾
第一步:燃烧秸秆,收集草木灰,称取20.00g。
第二步:用60℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90g固体。

图1实验中,用60℃的温水而不用冷水浸洗的原因是。
取实验一中所得固体3.30g进行图3实验。

实验中需缓慢滴入稀硫酸,原因是。
称量图3中反应前后烧杯和其中溶液的总质量,增重0.92g。计算草木灰中碳酸钾的质量分数为%,与表格中数据相比明显偏低,原因可能是(填序号)。
a.烧杯中溶液与空气接触 b.固体含有其它钾盐 c.固体含有氯化钠
我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有(写一条)。
[作出猜想]猜想一:
猜想二:CaCO3和Ca(OH)2
猜想三:CaCO3
[实验步骤与现象]
步骤 | 操作 | 现象 |
1 | 取lg样品于试管中,加入10mL蒸馏水充分振荡 | 得到上层清液和下层固体 |
2 | 向步骤1后的试管中滴加几滴酚酞 | 溶液变红 |
3 | 向步骤2后的试管中逐滴滴加稀盐酸 | 溶液由红色变为无色,固体物质消失,并产生气泡 |
[实验分析]
①实验人员根据步骤I认为猜想三正确。其实该结论并不严密,请说明理由。
②解释步骤3有气泡产生的原因(用化学方程式表示)。
[实验结论]通过以上实验可以知道猜想正确。
[评价与反思]熟石灰存放时应密封保存。农业上使用库存较久的熟石灰时要检测其成分。
 )的颜色与状态:
)的颜色与状态:
①称取0.3g碳酸钾,加10mL蒸馏水溶解。用到的玻璃仪器有、玻璃棒、烧杯。
②取少许所配溶液,再滴加氯化钙溶液,观察到的现象是
③另取少许所配溶液缓缓滴加稀盐酸并振荡,观察到开始无气泡产生,一段时间后产生气泡,原因是,在实验过程中,先发生 , 后发生(写出化学方程式)。

猜想一:只含有KOH; 猜想二:含有KOH、; 猜想三:KOH、Ca(OH)2
实验步骤 | 实验现象 | 实验结论 |
①取溶液少许于试管中,滴加过量稀盐酸 | 猜想二不正确 | |
②取溶液少许于试管中,滴加少许溶液 | 猜想三正确 |
①步骤2中发生反应的化学方程式为。
②含有KOH、Ca(OH)2的废水直接排放会造成水体污染。某小组同学对废水做如下处理(见下图)。C烧杯中出现现象时。说明水中已无KOH、Ca(OH)2。

【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。

甲同学在实验过程中测得pH变化如图1所示,则该同学是将(填字母序号)。
a.氢氧化钾溶液滴入稀硫酸中 b.稀硫酸滴入氢氧化钾溶液中
乙同学在实验过程中测得反应混合溶液的温度变化如图2所示,说明稀硫酸与氢氧化钾溶液发生的反应是(填“放热”或“吸热”)反应。图2中B点表示的含义是。
丙同学通过图3所示实验,他观察到溶液由红色变成无色,也证明氢氧化钾溶液与稀硫酸发生了化学反应,反应的化学方程式为。
【猜想与假设】
猜想一:只有K2SO4;猜想二:有K2SO4和H2SO4;猜想三:有K2SO4和KOH
【进行实验】为了验证猜想,学习小组选用Fe2O3粉末、BaCl2溶液,进行如下探究:
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 取少量反应后的溶液于试管中,加入Fe2O3粉末 | 溶液中有H2SO4猜想二正确 | |
方案二 | 取少量反应后的溶液于试管中,滴加BaCl2溶液 | ②产生白色沉淀 | 溶液中有H2SO4 , 猜想二正确 |
【实验结论】通过探究,同学们一致确定猜想二是正确的。
丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是。
【提出问题】该白色粉末的成分是什么?
【查阅资料】
①部分物质在水中的溶解性表(室温):
物质 | AgNO3 | AgCl | Ag2SO4 | AgCO3 |
溶解性 | 溶 | 不溶 | 微溶 | 不溶 |
②AgOH不稳定,在溶液中分解生成难溶于水的物质。
实验步骤 | 实验现象及结果 | 实验结论 |
①取该白色粉末样品于烧杯,加足量水溶解。 | 样品全部溶解,得到无色溶液A | 白色粉末中不含 |
②取少量无色溶液A于试管,加入过量BaCl2溶液,充分反应后过滤 | 到无色溶液B和白色沉淀C | 白色粉末中含有 |
③向白色沉淀C中加入过量稀盐酸 | 沉淀部分溶解,并有气泡冒出 | |
④在无色溶液B中滴加几滴AgNO3溶液 | 产生白色沉淀 | 白色粉末中含有NaCl |
①白色沉淀C中加入过量的稀盐酸,产生气泡的反应方程式为。
②在老师的指导下,通过讨论,同学们认识到由上述实验探究尚不能得出白色粉末中含有NaCl,理由是。
为了进一步确定白色粉末中是否含有NaCl,继续进行如下探究。
实验步骤 | 实验现象 | 实验结论 |
⑤另取少量无色溶液A于试管中,加入过量的溶液,振荡,静置 | 产生白色沉淀 | 白色粉末中含有NaCl |
⑥取实验⑤所得上层清液于试管,加入AgNO3溶液 | 产生白色沉淀 |
通过上述实验探究,确定了该白色粉末的成分。
【拓展与反思】在混合溶液中,检验某种离子时,需排除离子间的相互干扰。
实验步骤 | 实验现象 | 实验结论 |
| 步骤①木条不复燃; 步骤②产生气泡,溶液变蓝色; 步骤③。 | 硫酸铜能作过氧化氢分解的催化剂,反应的化学方程式为。 |
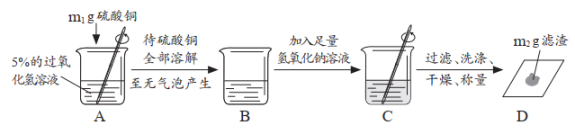
根据上述实验中m1:m2=,证明反应前后铜离子没有发生变化;将实验方案中的氢氧化钠溶液换成溶液,再次实验,证明反应前后硫酸根离子也没有发生变化。

实验完毕后,小明误将A试管中的物质倒入B试管中,充分振荡后,观察到混合后溶液为无色。小明对该无色溶液的成分产生兴趣并展开探究(温馨提示:本题中番号①~⑤为答题卡上的序号)。
【查阅资料】NaCl溶液、CaCl2溶液显中性。
【猜想与假设】猜想-:NaCl、CaCl2;
猜想二:NaCl、CaCl2、HCl;
猜想三:NaCl、CaCl2、Ca(OH)2;
经分析猜想三错误,其理由是。
|
实验操作 |
实验现象 |
解释与结论 |
|
取少量混合后的无色溶液于试管中,加入锌粒 |
|
解释实验现象:(用化学方程式表示) 得出实验结论:猜想二正确 |
Ⅰ.有同学提议将上表操作中的锌粒换成另一种药品或用品:(除金属外),也可得出猜想二正确的实验结论。
Ⅱ.小明误倒后,如果观察到试管底部有白色沉淀,上层清液为红色,则上层清液中一定有的阴离子是(填写离子符号)。