 表示向硫酸铜溶液中不断滴入氢氧化钡溶液
B .
表示向硫酸铜溶液中不断滴入氢氧化钡溶液
B .  表示将两份质量相等的固体物质分别加热制取氧气
C .
表示将两份质量相等的固体物质分别加热制取氧气
C .  表示向一定温度下氢氧化钙的饱和溶液中加入少量氧化钙固体
D .
表示向一定温度下氢氧化钙的饱和溶液中加入少量氧化钙固体
D .  表示向等质量的镁条和铝条中分别加入足量的溶质质量分数相同的稀硫酸
表示向等质量的镁条和铝条中分别加入足量的溶质质量分数相同的稀硫酸
已知:①部分银盐的溶解性如下表
|
|
NO3- |
Cl- |
CO32- |
|
Ag |
溶 |
不 |
不 |
②氯化银不溶于稀硝酸。
实验Ⅰ、取纯碱样品,加水溶解得溶液X,测得溶液pH约为12。
实验Ⅱ、取溶液X,滴加过量试剂Y,产生能使澄清石灰水变浑浊的气体。
实验Ⅲ、向实验Ⅱ后所得溶液中滴加硝酸银溶液,有白色沉淀生成。
结论:样品中含有氯化钠。
①测定溶液pH的操作:用玻璃棒蘸取溶液滴在pH试纸上,与相比较。
②实验Ⅱ中所加的试剂Y应选用(填字母)。
a、稀盐酸 b、稀硝酸 c、氢氧化钠溶液 d、氯化钙溶液
③由上述实验推断,溶液X中含有的阴离子除Cl-外,还有(填离子符号)。
准确称取2.000g干燥纯碱样品,加水溶解,逐滴加入溶质质量分数为3.65%的稀盐酸,边滴加边搅拌,当两者恰好完全反应时(含碳物质全部转化为CO2),消耗盐酸体积为37.00mL。(该盐酸的密度近似等于1g·mL-1 , 杂质不与盐酸反应)
①通过计算判断该纯碱样品的等级。(写出计算过程)
无水碳酸钠等级规定如下:
|
|
优等品 |
一等品 |
合格品 |
|
碳酸钠质量分数 |
≥99.2% |
≥98.8% |
≥98.0% |
②实验发现,当滴入盐酸体积略少于37.00mL时,溶液pH就降至7以下(约为5),溶液pH小于7的原因是。将此时的溶液煮沸,pH会略有升高,其原因。
a.酸性 b.吸水性 c.氧化性 d.脱水性
①如图是氢氧化钠溶液与盐酸反应的示意图,用实际参加反应的离子符号来表示该反应的式子可写为。

②若向稀氢氧化钠溶液中滴入几滴酚酞溶液,然后再向其中滴入稀盐酸至过量,则观察到溶液颜色的变化是。
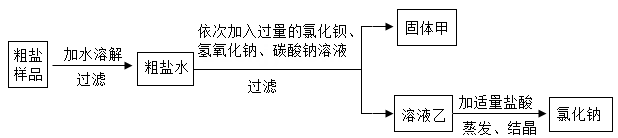
①溶解、过滤、蒸发的操作中都需要用到的一种玻璃仪器为(填“烧杯”“漏斗”或“玻璃棒”)。
②固体甲中所含有的难溶性物质为BaSO4、、CaCO3和BaCO3。
③请设计实验验证溶液乙中所含有的杂质。(简要叙述实验步骤及现象)
①加强营养。午餐食用米饭、清蒸鱼、青菜、牛奶,其中富含维生素C的食物是。
②勤通风消毒。家庭常用75%的医用酒精(主要成分乙醇C2H6O)消毒,乙醇分子中C、H、O原子的个数比为;次氯酸钠(NaClO)也是一种常用的消毒剂,其中氯元素的化合价为,制取次氯酸钠的反应为: , X的化学式为。
请写出①发生反应的化学方程式。
碳的资源化利用 中国科学家已实现由CO2到淀粉的全人工合成,主要过程如下:
![]()


①推测分子中氢原子数目:甲醇甲醛(填“>”、“<”或“=”)。
②为使甲醇持续转化为甲醛,反应b需补充H2O2.理论上需补充的H2O2与反应a中生成的H2O2的分子个数比≥。
补充完整步骤Ⅱ的化学方程式:。该反应前后碳元素的化合价(填“升高”、“降低”或“不变”)。
甲酸在催化剂作用下分解生成H2和CO2 , H2和CO2的分子个数比为。
已知:①相同条件下,气体的体积比等于分子个数比。
②甲酸除分解为H2和CO2外,还可能按如下方式分解:
根据甲酸分解原理,推测气体产物的成分在常温下有三种可能:H2和CO2;CO;(填化学式)。
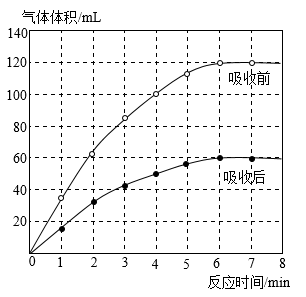
①气体通过氢氧化钠溶液后体积减小的原因是(用化学方程式表示)。
②甲酸催化分解所得气体产物的主要成分为(填化学式)。

①
②
③
结合以上装置,适合作为实验室制取NH3的反应原理有(填序号)。

【提出问题】泡腾片太空实验中产生的气体是什么?产生该气体的反应原理是什么?
【作出猜想】兴趣小组的同学们作出了如下猜想:
①氧气②二氧化碳③氢气④一氧化碳⑤氮气
大家一致认为作为药品,因一氧化碳有毒,应无一氧化碳。

①图2中仪器a的名称是。
②若要随时取用①或②气体,其发生装置应选用图2中的(填装置序号);用G装置干燥该气体,气体应从端(填m或n)通入,收集该气体应选用图2中的(填装置序号)。
③同学们利用上述装置收集了两瓶该气体,作如下验证实验。
检验猜想 | 实验步骤 | 实验现象 | 实验结论 | |
①或② | 将带火星的木条伸入其中一瓶中。 | 猜想①不正确 | 泡腾片放入水中产生的气体为二氧化碳。 | |
向另一瓶中注入适量的澄清石灰水,振荡。 | 猜想②正确 | |||
①泡腾片溶于水的过程中,柠檬酸(H3Ci)与碳酸氢钠反应的化学方程式。
②从图3分析H3Ci和NaHCO3反应的微观实质是。


步骤一:加入一定量除锈后的碎铁皮
步骤二:加入含有少量铁黄晶种的悬浊液;
步骤三:滴加少量FeSO4溶液;
步骤四:控制合适条件,边搅拌边鼓入空气,充分反应48小时,得到大量FeOOH沉淀。
①将三颈烧瓶中所得FeOOH沉淀分离出来的实验操作是(填操作名称)。
②为提高产品纯度,需洗涤分离出的沉淀。洗涤前沉淀表面吸附的阴离子为(填离子符号)。
③实验中仅滴加少量FeSO4溶液,就能得到大量FeOOH沉淀,其原因是。

加入稀盐酸质量/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | X | 2.0 | 1.0 | 0.4 | 0.4 |
请完成下列问题:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
残留金属的质量(g) | 21.75 | 18.5 | 15.25 | 15.25 |
试分析并计算:
可供选择的试剂有:NaOH溶液、KOH溶液、BaCl2溶液。
该小组的同学称取固体样品20g,向其中加入135.9g水全部溶解,再加入40g所选试剂,恰好完全反应,得到Na2SO4溶液和4.9g沉淀。回答并计算:

①氢氧化钠固体应放在玻璃器皿中称量的原因是;
②用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果(选填“偏大”、“偏小”或“不变”)。
加盐酸的次数 | 第一次 | 第二次 |
加盐酸的质量/g | 40.0 | 40.0 |
生成气体的质量/g | 3.3 | 1.1 |