
反应①2FeTiO3+6C+7Cl22TiCl4+2FeCl3+6CO
反应②2Mg+TiCl4Ti+2MgCl2
下列有关说法错误的是( )


选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag与NH3•H2O能大量共存 |
B | 向酸性KMnO4溶液中加入Fe3O4粉末 | 紫色褪去 | Fe3O4中含二价铁 |
C | 向乙醇中加入一块金属钠 | 有气泡产生 | 乙醇中含有水 |
D | 向蓝色石蕊试纸上滴加新制氯水 | 试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
①v正 (H2O) =2v逆(HF)
②SiF4的体积分数不再变化
③容器内气体压强不再变化
④4 molH-O键断裂的同时,有2molH- F 键断裂
⑤混合气体的体积不再变化

下列说法正确的是( )
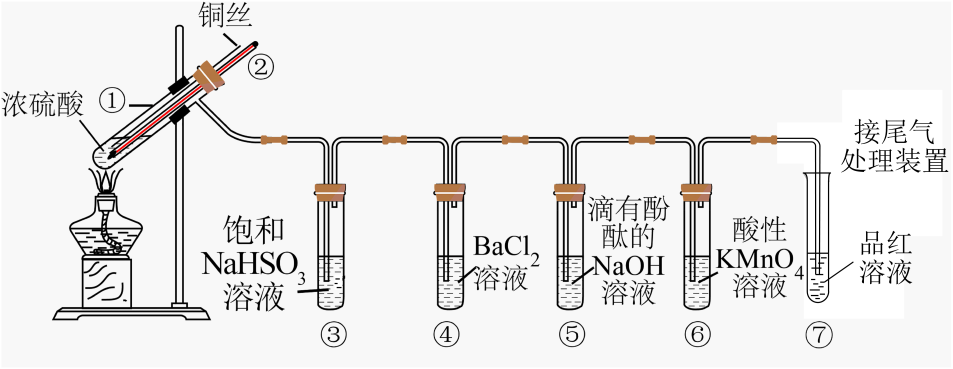
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4 , 可立刻向试管①中加水,观察颜色
a.HCl b.Fe2O3 c.KNO3
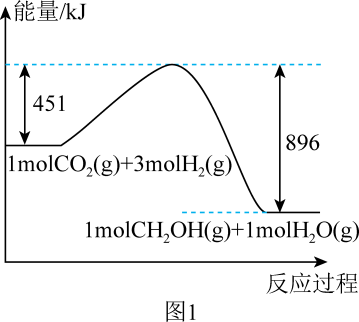
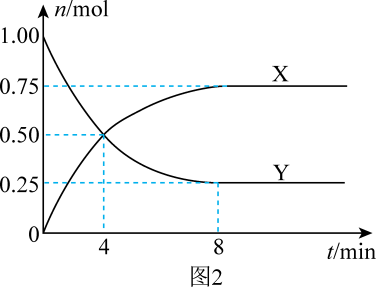
①Y代表的反应物的化学式为。
②4min时,v正v逆(填“>”“<”或“=”)。
③若要增大反应速率,可采取的措施有(写一条即可)。
④反应开始至4min时,X的平均反应速率为。
⑤若该反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测得三个容器中的反应速率分别为甲:v(CO2)=0.3mol·L-1·min-1 , 乙:v(H2)=0.52mol·L-1·min-1 , 丙:v(CH3OH)=0.1mol·L-1·s-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为。

a.水 b.溴的四氯化碳溶液 c.酸性高锰酸钾溶液