选项 | 实验操作 | 现象 | 结论 |
A | 把水滴入盛有少量 | 木条复燃 | 水中的氧元素被氧化 |
B | 将6mL | 加KSCN溶液后溶液显红色;加淀粉溶液后溶液显蓝色 |
|
C | 用玻璃棒蘸取某无色溶液在火焰上灼烧 | 火焰出现黄色 | 溶液中含钠元素 |
D | 将 | 溶液红色褪去 |
|



选项 | 劳动项目 | 化学知识 |
A | 用二氧化硫漂白草帽 | 二氧化硫具有漂白性 |
B | 把石灰浆喷涂在树皮上,消灭过冬虫卵 | 碱性环境使虫卵蛋白质变性而死亡 |
C | 用热的纯碱溶液洗涤餐具 | 纯碱能使油脂硬化 |
D | 用白醋去除铁栏杆上的锈迹 | 乙酸可与铁锈反应 |
选项 | 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
A | 把SO2和气体X一起通入到BaCl2溶液中 | 有白色沉淀产生 | X气体具有强氧化性 |
B | 向某溶液中加入稀盐酸酸化,再加入BaCl2溶液 | 加入BaCl2溶液后有白色沉淀生成 | 该溶液中存在 |
C | 用洁净的铂丝蘸取某溶液进行焰色试验 | 焰色呈黄色 | 该溶液为钠盐溶液 |
D | 向KMnO4溶液中通SO2 | 溶液褪色 | SO2具有漂白性 |
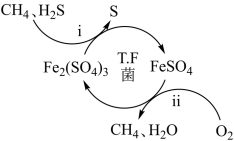

下列说法正确的是( )
实验一:与漂白粉(已在空气中露置了一小段时间)反应的实验探究
步骤①:取4g漂白粉固体,加入100mL水,固体有少量不溶解,溶液略有颜色,过滤,pH计测得漂白粉溶液的pH约为12。
步骤②:将持续通入漂白粉溶液中,液面上方出现白雾,稍后出现浑浊,溶液变为黄绿色,最后产生大量白色沉淀,黄绿色褪去。
a.用湿润的淀粉碘化钾试纸检验白雾,无变化;
b.用硝酸酸化的溶液检验白雾,产生白色沉淀A。
实验a的目的是;白色沉淀A为(填化学式)。
实验二:与
溶液反应的实验探究
实验步骤:将一定量的通入
溶液中,有白色沉淀生成。
经分析,与
溶液反应可能有两种情况:
c.若通入少量 , 则反应为
d.若通入过量 , 则反应为
为了探究发生了哪一种情况,取上述反应后过滤所得的溶液,分别装入A、B、C、D四支试管中,进行如下实验:

A.试管Ⅰ中有气体生成 B.试管Ⅱ中溶液颜色发生了变化
C.试管Ⅲ中有气体生成 D.试管Ⅳ中有白色沉淀生成

①装置A中,橡皮管a的作用是使分液漏斗中的液体能顺利流下
②装置B中,紫色溶液变红,证明二氧化硫是酸性氧化物
③装置C中,品红溶液褪色;证明二氧化硫具有漂白性
④装置D中溶液变浑浊,生成了硫单质,证明SO2具有还原性
【实验装置】

【实验现象】一段时间后,F、H中无明显现象,I中比G中的溶液先变浑浊。
【实验结论】在水中,SO2歧化的离子方程式为。该反应中的催化剂是 (填写序号)。
①H⁺ ②I⁻ ③H⁺、I⁻ ④K⁺、H⁺ ⑤K⁺、I⁻

已知:SO2熔点-75.5℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
请回答下列问题:
实验开始前打开活塞K1、K2 , 关闭活塞K3 , 通入一段时间N2后,关闭活塞K1、K2 , 打开活塞K3 , 用酒精喷灯高温加热绿矾。
A装置中发生反应的化学方程式为。
在装置中先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入SO2流速一致。四次实验分别得到如表pH-t图:
① | ② | ③ | ④ |
已煮沸的BaCl2(aq) | 未煮沸的BaCl2(aq) | 已煮沸的Ba(NO3)2(aq) | 未煮沸的Ba(NO3)2(aq) |
|
|
|
|
C装置中覆盖食用油的目的是。

①X为(填化学式)。
②实验室检验X所需试剂及实验现象。

装置A中发生反应的化学方程式为。
称取1.700 g产品放入250 mL的锥形瓶中,加入100.00 mL溶液和少量稀硫酸,发生反应: , 产品中其他杂质不与反应。反应完全后,用
标准溶液滴定过量的,发生反应:
, 消耗
标准溶液30.00 mL。
配制100 mL
溶液所需要的玻璃仪器有量筒、烧杯、玻璃棒、。