选项 | 事实 | 解释 |
A | NH3的热稳定性比PH3强 | NH3分子间能形成氢键 |
B | 基态Fe3+比Fe2+稳定 | 基态Fe3+价电子排布式为3d5 , 是半充满的稳定结构 |
C | 石墨能够导电 | 石墨是离子晶体 |
D | CH4与H2O分子的空间构型不同 | 它们中心原子杂化轨道类型不同 |
 C . 醛基的碳氧双键有极性:
C . 醛基的碳氧双键有极性: D . 组成天然蛋白质的氨基酸可以表示为
D . 组成天然蛋白质的氨基酸可以表示为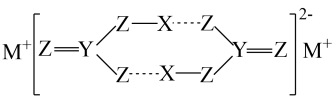
物质 | ||||
熔点/℃ | 827 | 275 | 394 | 446 |
与
熔点相差较大,
、
、
熔点依次增大,原因是。
物质 | 电离平衡常数 |
| |
|
从结构角度分析顺丁烯二酸的小于反丁烯二酸的
的原因是。
|
物质 |
|
|
|
|
熔点 |
280℃ |
3550℃ |
3652℃ |
和金刚石熔点相差大,石墨的熔点比金刚石高,原因是。
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚()提取,效果更好。
①乙醚的沸点低于乙醇,原因是。
②用乙醚提取效果更好,原因是。
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中C、H、O的原子核附近电子云密度大小:。
②图中晶胞的棱长分别为a、b
、c
, 晶体的密度为
。(用
表示阿伏加德罗常数;
;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
一定条件下,用将青蒿素选择性还原生成双氢青蒿素。

①双氢青蒿素分子中碳原子的杂化轨道类型为。
②的空间结构为。
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
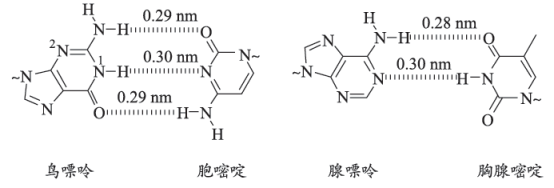
①鸟嘌呤中2号N的杂化类型为。
②鸟嘌呤中N—H键的平均键长。(填“大于”“小于”或“等于”)0.29nm。
①碱基中,O、N能与H形成氢键而C不能,原因是。
②下列说法正确的是(填序号)。
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
①鸟嘌呤异构化后的结构简式为。
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是。。

①在元素周期表中铜位于区(填“s”、“p”、“d”或“ds”)。C、N、O三种元素的电负性由大到小的顺序为。
②邻氨基吡啶的铜配合物中,Cu2+的配位数是,N原子的杂化类型有。
①1体积水可溶解约1体积CO2 , 1体积水可溶解约700体积NH3 , NH3极易溶于水的原因是,反应时,向饱和NaCl溶液中先通入。
②NaHCO3分解得Na2CO3 , 空间结构为。
①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是。

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。

一个T-碳晶胞中含有个碳原子,T-碳的密度非常小为金刚石的一半,则T-碳晶胞的边长和金刚石晶胞的边长之比为。
物质 | 熔点 | 沸点 |
偏二甲肼 | -58℃ | 63.9℃ |
肼 | 1.4℃ | 113.5℃ |
偏二甲肼中氮原子的杂化方式为,二者熔沸点存在差异的主要原因是。


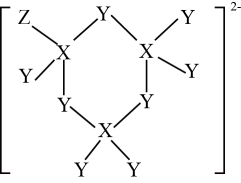
铁酸钇的化学式为。已知1号O原子分数坐标为(0,0,),2号O原子分数坐标为(
,
-m,
-n),则3号Fe原子的分数坐标为。已知铁酸钇的摩尔质量为Mg·mol-1 , 晶体密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 该晶胞的体积为pm3(列出表达式)。
 )水溶性优于2﹣巯基烟酸氧钒配合物 (
)水溶性优于2﹣巯基烟酸氧钒配合物 ( )的原因是。
)的原因是。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为 (0,0,0),D为 ( ,
, 0),则E原子的坐标参数为。X﹣射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为pm (只列计算式)。
②已知六方氮化硼同层中B﹣N距离为acm,密度为dg/cm3 , 则层与层之间距离的计算表这式为pm (已知正六边形面积为 , a为边长)。
③同一周期中,第一电离能介于B、N之间的元素有种。
元素符号 | Li | Be | Na | S | Cl |
原子半径/pm | 152 | 89 | 186 | 102 | 99 |
由此可推理:决定原子半径大小的因素有
①的沸点(-33.5℃)高于
的沸点(-129℃)的主要原因是
②的一种下游产品三聚氟氰(分子式为:
),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式。
①1个乙二胺分子中含sp3杂化的原子个数为,分子中电负性最大的元素是 ;
②Ni(H2O)6]2+中H2O与Ni2+之间以键结合在一起,在与乙二胺反应的过程中,Ni2+的轨道杂化类型是否发生改变? (填“是”或“否”) ;
③沸点:乙二胺(116℃)<乙二醇(197℃), 其原因是:。
①该晶胞中O原子的数目为。
②设NA为阿伏加德罗常数的值,TiO2 的摩尔质量为80g/mol,则TiO2晶胞的密度为g·cm-3(列出计算表达式)
