 B .
B .  C .
C .  D .
D . 
 B . 加热液体
B . 加热液体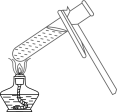 C . 量取水时读数
C . 量取水时读数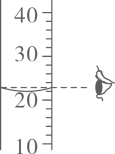 D . 称量氯化钠固体
D . 称量氯化钠固体

选项 | 实验目的 | 实验方案 |
A | 除去Cu(NO3)2溶液中的AgNO3 | 加入过量铁粉,过滤 |
B | 分离KCl和MnO2固体 | 加水溶解,过滤 |
C | 除去NaCl固体中少量的NH4Cl | 加入足量Ca(OH)2固体,研磨 |
D | 鉴别羊毛线和棉线 | 取样,在空气中灼烧,闻气味 |


A.食盐 B.明矾 C.石墨 D.氮气 E.熟石灰



温度/℃ | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NH4Cl | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①40℃时,NH4Cl的溶解度是g。60℃时,向100g水中加入120gKNO3固体,所得溶液的质量是g。
②将等质量的NH4Cl、KNO3饱和溶液分别由50℃降温至20℃,所得NH4Cl溶液中溶质的质量分数(填“<”“=”或“>”)KNO3溶液中溶质的质量分数。
二氧化硫是有刺激性气味的无色气体;易溶于水,溶于水中时,会形成亚硫酸(H2SO3)。二氧化硫是大气污染物之一,空气中的二氧化硫主要来源于火山的喷发、工业废气的排放以及煤的燃烧。二氧化硫也是食品加工中常用的漂白剂和防腐剂,广泛应用于干制果蔬、面粉、葡萄酒等食品的加工,但必须严格按照国家有关范围和标准使用。


如图甲所示,将稀盐酸逐滴滴到烧杯中,当看到烧杯中的溶液恰好由色变为无色时,即停止了滴加稀盐酸。烧杯中所发生反应的化学方程式为。
如图乙和丙所示,实验探究碱的化学性质。图乙中向下推注射器的活塞后,可观察到的现象是。
【交流讨论】
①废液缸中的废液呈红色,说明废液显性(填“酸”“碱”或“中”)。
②废液缸中的废液明显变浑浊,说明倾倒前丙的溶液中含有(填化学式)。
【做出猜想】猜想一:NaOH;猜想二:NaOH和Ca(OH)2;猜想三:NaOH和Na2CO3
【查阅资料】BaCl2溶液呈中性。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取少量废液缸中的上层红色清液于试管中,加入过量BaCl2溶液,静置 | 有白色沉淀生成,溶液仍呈红色 | 猜想成立 |
加入次数 | 第1次 | 第2次 | 第3次 |
加入稀硫酸的质量/g | 100 | 100 | 100 |
充分反应后剩余固体的质量/g | 43.5 | m | 34 |
请根据实验数据计算,并回答下列问题。