周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
 B . H2O的空间填充模型为
B . H2O的空间填充模型为 D . 乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:
D . 乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体: C . 基态
C . 基态 
| 选项 | A | B | C | D |
| 试剂a | CuSO4 | NH4HCO3 | H2SO4 | CH3COOH |
| 试剂b | Ba(OH)2 | Ca(OH)2 | Ba(OH)2 | NH3·H2O |

已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以
存在。
回答下列问题:
已知: ,
;
电离常数分别为
、
。
①在弱碱性溶液中,与
反应生成
、
和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,
去除水中
的速率越慢,原因是。


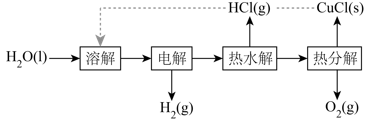
①电解在质子交换膜电解池中进行。阳极区为酸性溶液,阴极区为盐酸,电解过程中
转化为
。电解时阳极发生的主要电极反应为(用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有(填元素符号)。
①实验中发现,在时,密闭容器中
溶液与铁粉反应,反应初期有
生成并放出
, 该反应的离子方程式为。
②随着反应进行,迅速转化为活性
, 活性
是
转化为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为。

③在其他条件相同时,测得Fe的转化率、的产率随
变化如题图所示。
的产率随
增加而增大的可能原因是。


时相关物质的参数如下:
的溶解度:
化合物 | |

回答下列问题:
|
|
|
|
|
|
|
|
|
|
|
|

A.、
、
B.
、
、
C.、
、
D.
、
、
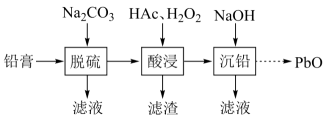
一些难溶电解质的溶度积常数如下表:
难溶电解质 | ||||
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物 | ||||
开始沉淀的 | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的 | 3.2 | 8.3 | 4.6 | 9.1 |
回答下列问题:
(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属
在醋酸中转化为
, 其化学方程式为;
(ⅲ)也能使
转化为
,
的作用是。


① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是,为了能观察到溶液Ⅰ中
的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ;
,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为,平衡常数为(用K1和K2表示)。
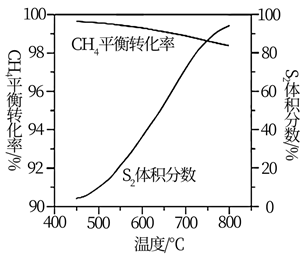
①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数