|
|
|
|
A.滴入酚酞溶液 | B.吸氧腐蚀 | C.钠的燃烧 | D.石蜡油的热分解 |
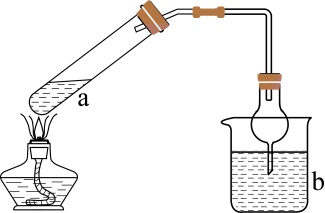
a中反应 | b中检测试剂及现象 | |
A | 浓 | 淀粉 |
B |
| 品红溶液褪色 |
C | 浓 | 酚酞溶液变红 |
D |
| 溴水褪色 |
由海水制取蒸馏水 | 萃取碘水中的碘 | 分离粗盐中的不溶物 | 由 |
|
|
|
|
A | B | C | D |
装置示意图 | 序号 | 电解质溶液 | 实验现象 |
| ① | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 | |
② | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 |
下列说法错误的是( )
选项 | 实验内容 | 预测的实验现象 |
A |
| 产生白色沉淀后沉淀消失 |
B |
| 溶液变血红色 |
C | AgI悬浊液中滴加NaCl溶液至过量 | 黄色沉淀全部转化为白色沉淀 |
D | 酸性 | 溶液紫红色褪去 |
|
|
|
|
A.过滤 | B.排空气法收集 | C.混合浓硫酸和乙醇 | D.溶液的转移 |

|
|
|
|
|
|
开始沉淀pH |
1.9 |
4.2 |
6.2 |
|
沉淀完全pH |
3.2 |
6.7 |
8.2 |
下列说法错误的是( )
 B .
B .  D .
D . 
|
|
方案设计 |
现象和结论 |
|
A |
先加入少量KClO3溶液,再加 |
若产生白色沉淀,则样品为亚硝酸钠 |
|
B |
加到少量 |
若溶液褪色,则样品为亚硝酸钠 |
|
C |
先加到少量 |
若溶液变黄色,则样品为亚硝酸钠 |
|
D |
先加入少量 |
若产生白色沉淀,则样品为亚硝酸钠 |
|
实验 |
操作与现象 |
|
① |
在 |
|
② |
在 再滴加 |
|
③ |
在 将上述混合液分成两份,一份滴加 另一份煮沸,产生红褐色沉淀。 |
依据上述实验现象,结论不合理的是( )
| 选项 | 劳动项目 | 化学知识 |
| A | 面包师用小苏打作发泡剂烘焙面包 | |
| B | 环保工程师用熟石灰处理酸性废水 | 熟石灰具有碱性 |
| C | 工人将模具干燥后再注入熔融钢水 | 铁与 |
| D | 技术人员开发高端耐腐蚀镀铝钢板 | 铝能形成致密氧化膜 |

时相关物质的参数如下:
的溶解度:
化合物 | |

回答下列问题:
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、
(紫色)。
ii.浓碱条件下,可被OH-还原为
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

序号 | 物质a | C中实验现象 | |
通入Cl2前 | 通入Cl2后 | ||
I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
III | 40%NaOH 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为
。
①化学方程式表示可能导致溶液碱性减弱的原因,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为,溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。
步骤一:称取amg口服造影剂,加入Zn粉、NaOH溶液,加热回流,将碘番酸中的碘完全转化为I- , 冷却、洗涤、过滤,收集滤液。
步骤二:调节滤液pH,用bmol∙L-1AgNO3标准溶液滴定至终点,消耗AgNO3溶液的体积为cmL。
已知口服造影剂中不含其它含碘物质。计算口服造影剂中碘番酸的质量分数。
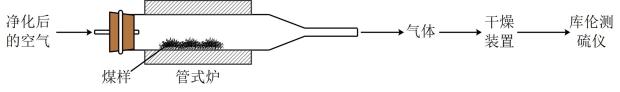
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。待测气体进入电解池后,
溶解并将
还原,测硫仪便立即自动进行电解到
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。

①在电解池中发生反应的离子方程式为。
②测硫仪工作时电解池的阳极反应式为。
已知:电解中转移电子所消耗的电量为96500库仑。
①测定过程中,需控制电解质溶液 , 当
时,非电解生成的
使得测得的全硫含量偏小,生成
的离子方程式为。
②测定过程中,管式炉内壁上有残留,测得全硫量结果为。(填“偏大”或“偏小”)
氧化物( | 产品中 | 产品中Mg杂质含量/% (以 | |||
计算值 | 实测值 | ||||
2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
备注:ⅰ、浸出率=(浸出的
质量/煅烧得到的
质量)
(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
实验Ⅰ:称取样品,用足量稀硫酸溶解后,用
标准溶液滴定
达终点时消耗
(滴定过程中
转化为
,
不反应)。
实验Ⅱ:另取样品,利用上述装置与足量
反应后,固体质量为
。
则;下列情况会导致n测量值偏小的是(填标号)。
A.样品中含少量杂质
B.样品与反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成

|
|
|
|
|
|
|
|
|
|
|
|

A.、
、
B.
、
、
C.、
、
D.
、
、

简要步骤如下:
Ⅰ.在瓶A中加入液氨和
, 通入氨气排尽密闭体系中空气,搅拌。
Ⅱ.加入钠粒,反应,得
粒状沉积物。
Ⅲ.除去液氨,得产品。
已知:几乎不溶于液氨,易与水、氧气等反应。
请回答:
准确称取产品→→→→计算
a.准确加入过量的水
b.准确加入过量的标准溶液
c.准确加入过量的标准溶液
d.滴加甲基红指示剂(变色的范围4.4~6.2)
e.滴加石蕊指示剂(变色的范围4.5~8.3)
f.滴加酚酞指示剂(变色的范围8.2~10.0)
g.用标准溶液滴定
h.用标准溶液滴定
i.用标准溶液滴定
②X难溶于水,但可溶于氨水中,写出该反应的离子方程式。
可选用试剂: 晶体、
溶液、浓
、稀
、
溶液、蒸馏水
步骤1. 的制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
产品。

步骤2.产品中 的含量测定
①称取产品 ,用
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的 溶液;
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
。
回答下列问题:


已知“降温收尘”后,粗 中含有的几种物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
136 |
127 |
57 |
180 |
回答下列问题:

|
物质 |
|
|
|
|
|
分压/ |
|
|
|
|
①该温度下, 与C、
反应的总化学方程式为;
②随着温度升高,尾气中 的含量升高,原因是。

提出假设 稀释 溶液或改变
浓度,
电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的
和
溶液,按下表配制总体积相同的系列溶液;测定
,记录数据。
|
序号 |
|
|
|
|
|
|
Ⅰ |
40.00 |
/ |
/ |
0 |
2.86 |
|
Ⅱ |
4.00 |
/ |
36.00 |
0 |
3.36 |
|
… |
|||||
|
Ⅶ |
4.00 |
a |
b |
3∶4 |
4.53 |
|
Ⅷ |
4.00 |
4.00 |
32.00 |
1∶1 |
4.65 |
①根据表中信息,补充数据: ,
。
②由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡(填”正”或”逆”)向移动;结合表中数据,给出判断理由:。
③由实验Ⅱ~VIII可知,增大 浓度,
电离平衡逆向移动。
实验结论 假设成立。
查阅资料获悉:一定条件下,按 配制的溶液中,
的值等于
的
。
对比数据发现,实验VIII中 与资料数据
存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定
溶液的浓度再验证。
(ⅰ)移取 溶液,加入2滴酚酞溶液,用
溶液滴定至终点,消耗体积为
,则该
溶液的浓度为
。在答题卡虚线框中,画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述 溶液和
溶液,配制等物质的量的
与
![]() 混合溶液,测定pH,结果与资料数据相符。
混合溶液,测定pH,结果与资料数据相符。
|
Ⅰ |
移取 |
|
Ⅱ |
,测得溶液的pH为4.76 |
实验总结 得到的结果与资料数据相符,方案可行。

已知:月桂酸 熔点为
;月桂酸和
均难溶于水。该工艺条件下,稀土离子保持
价不变;
的
;
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
| 离子 | | | | |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
②“操作X”的过程为:先,再固液分离。
①还原 和
熔融盐制备
时,生成
![]() 转移
转移 电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
的还原,发生的电极反应为。