| A.检验Na2O2与水反应生成的气体 | B.测定氯水的pH | C.制备纯净的Fe(OH)2 | D.检验溶液中的Fe2+ |
|
|
|
|
|
| 实验操作及现象 | 结论 | |
| A | 向 |
|
| B | 常温下,铁片放入稀硝酸、稀硫酸中,均有气泡产生 | Fe与两种酸均发生置换反应 |
| C | 将水滴入盛有 |
|
| D | 向某待测液溶液中滴加少量KSCN溶液,振荡,无明显现象,再加入几滴新制氯水,溶液变成红色 | 待测液中一定含有 |
| 选项 | 操作 | 现象 | 结论 |
| A | 向某溶液中滴加几滴KSCN溶液 | 溶液变红 | 溶液中不可能含Fe2+ |
| B | 将铝箔置于火焰上灼烧 | 铝箔胀大并有熔融物滴落 | 铝箔灼烧生成氧化铝 |
| C | 将几滴饱和FeCl3溶液滴入一烧杯的沸水中,继续煮沸至溶液呈红褐色,停止加热 | 用激光笔照射烧杯中的液体,看到一条光亮的“通路” | 生成了Fe(OH)3胶体 |
| D | 向新制氯水中滴加几滴紫色石蕊试液 | 溶液先变红后褪色 | 新制氯水具有酸性和强氧化性 |
绿矾是一种重要的化工原料.
【问题1】绿矾晶体(FeSO4•7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案.可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液请参与完成方案设计.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
方案1:取少量溶液,加入几滴 试剂,如果观察到的现象是 ;实验结论:证明绿矾样品没有被氧化.
方案2:取少量溶液,加入几滴 试剂,如果观察到的现象是 .
实验结论:证明绿矾样品完全被氧化.
使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 .
【问题2】以绿矾为原料可以制取聚合硫酸铁(SPFS).聚合硫酸铁是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.其组成可表示成Fex(OH)y(SO4)z•nH2O(其中Fe为+3价).工业上常用的一种制备流程为:

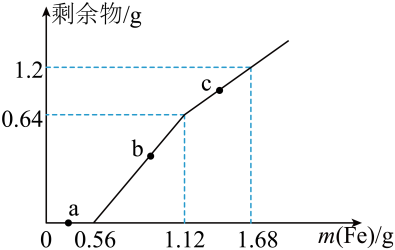
取7.507g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485g,向上述滤液中加入NH3•H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.800g.通过计算确定该固体聚合硫酸铁样品的化学式为 .(写出计算过程)

①取少量A,过滤得到红褐色沉淀和黄色透明液体B。
②取少量B于试管中,加入溶液,(填现象)。
③取少量B于试管中,加入(填试剂),液体变为红色。
④用激光笔照射B,看到一条光亮的“通路”。
综合上述实验,说明A中铁元素的存在形态有、
、和。
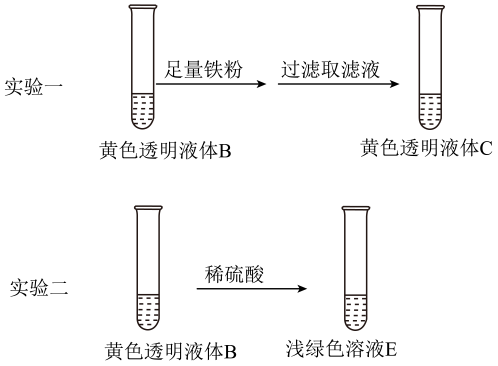
①实验一中,加入铁粉的作用是(用离子方程式表示)。
②由上述实验得出:B显黄色的主要原因不是因为含有 , 而是因为含有。理由是: 。
①取25.00mL A,加入足量稀硫酸,可与24.00mL溶液恰好完全反应。已知
在酸性环境下被还原为
, A中
的浓度为
, 说明其主要成分仍然是
。
②下列实验可以使用A进行的是(填字母)。
a.向A中滴入NaOH溶液,制备纯净的沉淀
b.用A处理含有+6价Cr的酸性废水,将剧毒的+6价Cr还原至低毒的+3价
经过上述探究,实验小组对溶液的配制与使用有了更深入的理解。
| 实验操作 | 实验现象 | 得出结论 |
| 取一定量 | 紫色褪去 | 维生素C可将 |
其他组同学认为:根据该实验现象不能得出“维生素C可将转化为
”的结论,原因是;认为可另外设计实验验证结论是否正确:取a溶液少许,滴加,若出现,则结论正确。
①时应加入的试剂是。
②“速力菲”(主要有效成分是)是一种常见的补铁药物,欲验证该药物超过保质期后已变质,可进行的操作是:除去药物表面包装的糖衣后将药物粉碎、加水溶解静置、取少许溶液于试管中,向其中加入,若出现现象,则证明该药物已变质。
③在中滴加NaOH溶液的实验现象是,发生反应的化学方程式是。
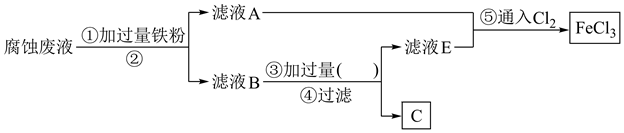
①滤液A中主要含有(填化学式,下同),滤渣B主要为。
②流程图中②的操作名称为,③处加过量的(填名称)。
③写出步骤⑤中反应的离子方程式:。

B中盛一定量的NaOH溶液,A中应预先加入的试剂是.实验开始时先将止水夹E打开,C中收集到气体的主要成分是.
①取新鲜菠菜切开表皮,在内部组织上滴加KSCN溶液,无颜色变化,说明菠菜中铁元素不以(填离子符号)形式存在.
②另取新鲜菠菜洗净、烘干,放入坩埚中灼烧成灰烬.冷却后将灰烬移入烧杯中,加入溶液至没有气体产生,加蒸馏水稀释,充分搅拌后过滤.取少量滤液于试管中,加入KSCN溶液,溶液变为色,由此推断滤液中有
.实验中加入
溶液的目的为.

A.还原铁粉 B.浓硫酸 C.稀硫酸 D.氢氧化钠溶液

用下面两种方法均可制得Fe(OH)2白色沉淀.
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 .
(2)除去蒸馏水中溶解的O2常采用 的方法.
(3)制取Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是:防止发生反应 .(填化学方程式)
方法二 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
(4)在试管Ⅰ里加入的试剂是 .
(5)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .

①写出实验2试管中发生反应的离子方程式:。
②请用离子方程式解释产生红棕色气体的原因:。
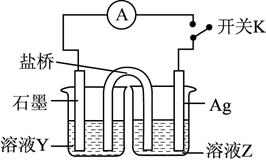
①溶液Y为。
②为实现该实验目的,接下来的操作及现象为。
,取实验2试管中充分反应静置后的上层清液
,用
标准溶液滴定,至终点时消耗
标准溶液。
①判断滴定终点现象为;
②实验2试管中反应的平衡常数 。
③不取用实验1反应后所得清液测定反应的平衡常数的原因: 。
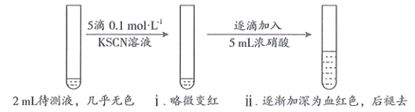
用KSCN检验 的原理是(用离子方程式表示)。
|
步骤 |
操作 |
现象 |
|
Ⅰ |
取2mL待测液,加入5滴0.1 | 溶液颜色无明显变化 |
| Ⅱ | 取2mL待测液, | 溶液变为红色 |
| Ⅲ | 向Ⅱ中所得溶液中逐滴加入5mL浓硝酸,边加边振荡 | 溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显 |
a.几乎未变质 b.部分变质 c.完全变质
从上述探究中获得启发,在用KSCN检验 及进行
还原性验证实验时,需要注意的事项有(至少2条)。

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
①配制:用分析天平称取1.400gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是
②滴定:用酸化的KMnO4溶液滴定:用移液管移取25.00mLFeSO4溶液于锥形瓶中,用0.0100mol·L-1的KMnO4溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24.00mL,则样品Fe2+的含量为%(保留2位小数)。
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号);
实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号),由此可以证明该氧化还原反应为。