有关物质的溶解度如图所示.
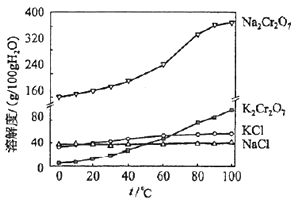
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是.
(14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
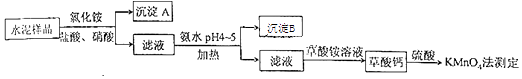
回答下列问题:

发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为;碳化硅又称,其晶体结构与相似.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和.
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | ﹣30.4 | ﹣84.9 | ﹣111.9 |
③SiHCl3极易水解,其完全水解的产物为.

已知: TiCl4 易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
|
|
熔点/℃ |
沸点/℃ |
密度/(g·cm-3) |
水溶性 |
|
TiCl4 |
-24 |
136.4 |
1.7 |
易水解生成白色沉淀,能溶于有机溶剂 |
|
CCl4 |
-23 |
76.8 |
1.6 |
难溶于水 |
回答下列问题:

已知:常温下,Ksp(AgCl)=1.8×10-10、 Ksp(Ag2CrO4)=1.1×10-12 , Ag2CrO4 呈砖红色,TiCl4+(2+n)H2O= TiO2·nH2O↓+4HCl。
①安全漏斗在本实验中的作用除加水外,还有;
②滴定终点的判断方法是;
③产品的纯度为(用含m、n和V的代数式表示)。