①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同

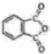 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(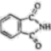 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。


①第四周期元素中,基态原子的未成对电子数与钛相同的有(填元素符号)。
②钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是。
①已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列(选填字母编号)。

②三醋酸锰[(CH3COO)3Mn]是一种很好的有机反应氧化剂。三醋酸锰[(CH3COO)3Mn]中阳离子的价层电子排布式中电子的自旋状态(填“相同”或“相反”)。
③Mn2+能形成配离子为八面体的配合物MnClm·nNH3 , 在该配合物的配离子中,Mn2+位于八面体的中心。若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1mol AgCl沉淀,则该配离子化学式为。

已知La为+3价,当被钙等+2价元素A替代时,可形成复合钙钛矿化合物LaxA1-xMnO3 , (x>0.9),此时一部分+3价锰转变为+4价,导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则复合钙钛矿化合物中+3价锰与+4价锰的物质的量之比为(用含x的代数式表示)。


①M中,碳原子的杂化形式有种。
②M中,不含(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健

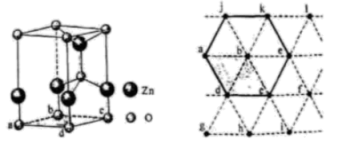
①4个微粒A,B,C,D中,属于氧原子的是
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,,);钛氧键键长d=(用代数式表示)。


回答下列问题: