选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到 | 先产生白色胶状沉淀,后沉淀溶解 |
|
B | 测定等浓度的 | 前者pH比后者大 | 非金属性:S>C |
C | 向2.0mL浓度均为 | 沉淀呈黄色 | |
D | 分别向两支盛有 | 前者产生无色气泡,后者无明显现象 | 酸性:醋酸>碳酸>硼酸 |
选项 | 目的 | 方案设计 | 现象和结论 |
A | 比较 | 向 | 溶液中出现白色沉淀,能确定酸性: |
B | 比较 |
| 白色沉淀转化为红褐色沉淀不能确定两者溶解度大小 |
C | 比较羟基的活泼性 | 将大小相同的金属钠分别投入水和乙醇中 | 钠与水反应比钠与乙醇反应剧烈,说明乙醇羟基中氢原子不如水分子中的氢原子活泼 |
D | 比较 | 向含有淀粉的酸性 | 溶液变蓝能确定氧化性: |

a中试剂 | b中试剂 | c中溶液 | |
A | 浓硫酸 | 浓盐酸 | 饱和食盐水 |
B | 浓硫酸 | Cu |
|
C | 稀硫酸 | 饱和 | |
D | 浓氨水 | 碱石灰 |
|
标号 | 实验目的 | 实验方法或操作 |
A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
B | 探究浓度对化学反应速率的影响 | 量取相同体积、不同浓度的HCl溶液,分别与等质量的大理石发生反应,对比现象 |
C | 探究室温下 | 用pH计测量室温下0.1 mol·L⁻¹氨水的pH |
D | 通过官能团的检验,鉴别乙醇和乙醛 | 取两种待测液体于两支洁净的试管中,加入新制氢氧化铜悬浊液,加热至沸腾,观察现象 |
选项 | 目的 | 实验方案 | 现象和结论 |
A | 探究铁粉和水蒸气反应的气体产物 | 将产生的气体通入肥皂水中,用燃着的木条靠近产生的气泡,观察现象 | 气泡破裂发出爆鸣声,说明生成的是H2 |
B | 探究浓度对反应速率的影响 | 向两支各装有4 mL 0.01 mol·L-1的酸性KMnO4溶液的试管中,分别加入0.1 mol·L-1的H2C2O4溶液2 mL和4mL,记录溶液褪色时间 | 加入草酸量多的试管褪色快,说明浓度越大反应速率越快 |
C | 探究HClO和 CH3COOH酸性强弱 | 取等浓度的NaClO溶液和CH3COONa 溶液,分别用 pH试纸测量,与标准比色卡对照 | CH3COONa溶液的pH较小,说明酸性:CH3COOH> HClO |
D | 探究AgCl和AgI的Ksp大小 | 向等浓度的NaCl和KI混合溶液中逐滴加入AgNO3溶液,观察沉淀颜色 | 先产生黄色沉淀,说明Ksp(AgCl)> Ksp (AgI) |
实验目的 | 实验设计 | |
A | 探究浓度对化学反应速率的影响 | 其他条件相同时,记录等浓度稀硫酸与不同浓度硫代硫酸钠溶液反应生成淡黄色沉淀的时间 |
B | 证明Fe3+和I-之间的反应是可逆的 | Fe3+与少量I-充分反应后,滴加KSCN溶液,若溶液变红色,则证明Fe3+和I-之间的反应是可逆的 |
C | 探究钠能否置换出醇羟基中的氢 | 将一小块钠放入无水乙醇中,观察是否有气泡产生,若有,则说明钠能置换出醇羟基中的氢 |
D | 制取并纯化氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸 |
实验目的 | 玻璃仪器 | 试剂 | |
A | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管、玻璃棒 | ①饱和氯化铁溶液②蒸馏水 |
B | 用银氨溶液检验葡萄糖中醛基 | 试管、烧杯、酒精灯、胶头滴管 | ①AgNO3溶液、浓氨水②葡萄糖溶液③蒸馏水 |
C | 除去粗盐水中的Ca2+、Mg2+、 | 胶头滴管、试管、烧杯、漏斗、玻璃棒 | ①粗盐水②氯化钡溶液③碳酸钠溶液④氢氧化钠溶液⑤稀盐酸 |
D | 制备乙酸乙酯 | 酒精灯、试管、导管 | ①乙醇②浓硫酸③乙酸④碎瓷片⑥饱和碳酸钠溶液 |
实验目的 | 玻璃仪器 | 试剂 | |
A | 除去苯中少量的苯酚 | 普通漏斗、烧杯、玻璃棒 | 浓溴水 |
B | 测定84消毒液的pH | 玻璃棒、表面皿 | pH试纸 |
C | 实验室制备乙烯 | 酒精灯、蒸馏烧瓶、温度计、导气管、胶头滴管 | 浓硫酸、乙醇、碎瓷片 |
D | 检验CH3CH2Br中的溴元素 | 试管、胶头滴管、酒精灯 | NaOH溶液、硝酸、AgNO3溶液 |
实验室制 | 实验室收集 | 验证 | 除去 |
|
|
|
|
| | | |
选项 | 探究方案 | 探究目的 |
A | 向盛有 |
|
B | 向盛有 |
|
C | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 |
|
D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |
|
选项 | 实验操作及现象 | 结论 |
A | 将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色 | Na2S2O3既体现还原性又体现氧化性 |
B | 将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 | Zn(OH)2既体现碱性又体现酸性 |
C | 将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟” | 水解性:TiCl4>FeCl3 |
D | 将红色固体CrO3加热,得到绿色固体Cr2O3 , 且生成的气体可以使带火星的木条复燃 | 热稳定性:CrO3<Cr2O3 |
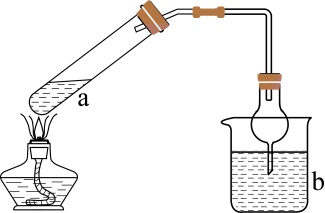
a中反应 | b中检测试剂及现象 | |
A | 浓 | 淀粉 |
B |
| 品红溶液褪色 |
C | 浓 | 酚酞溶液变红 |
D |
| 溴水褪色 |
选项 | 实验内容 | 预测的实验现象 |
A |
| 产生白色沉淀后沉淀消失 |
B |
| 溶液变血红色 |
C | AgI悬浊液中滴加NaCl溶液至过量 | 黄色沉淀全部转化为白色沉淀 |
D | 酸性 | 溶液紫红色褪去 |
选项 | 实验操作 | 现象 | 结论 |
A | 两支试管各盛 | 加入 | 其他条件相同,反应物浓度越大,反应速率越快 |
B | 向 | 溶液分层,上层呈橙红色 | 氧化性: |
C | 向含相同浓度的 | 溶液分层,下层呈紫红色 | 氧化性: |
D | 向葡萄糖溶液中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液紫色消失 | 葡萄糖中含有醛基 |
选项 | 实验目的 | 实验操作 |
A | 除去氨气中的水蒸气 | 将混合气体通入盛有浓 |
B | 验证 | 分别取相同体积、 |
C | 检验1-溴丁烷中含有溴元素 | 取适量样品于试管中,加入适量 |
D | 验证 | 向 |

实验操作 | 现象 | 结论 | |
A | 向氢氧化钠的乙醇溶液中加入1—溴丁烷,在一定条件下发生反应。将产生的气体通入 |
| 证明产生的气体中含有1—丁烯 |
B | 在物质X柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡 | 石蜡熔化呈椭圆形 | 说明物质X为非晶体 |
C | 将 | 溶液变为黄色 |
|
D | 向盛有KI溶液的试管中加入少量氯水 | 溶液变为黄色 | 非金属性: |
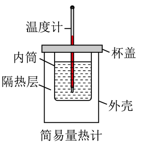 测定中和反应反应热
B .
测定中和反应反应热
B .  除去Fe2(SO4)3溶液中的FeSO4
C .
除去Fe2(SO4)3溶液中的FeSO4
C . 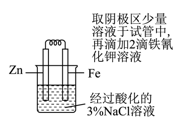 验证牺牲阳极法保护铁
D .
验证牺牲阳极法保护铁
D . 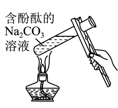 验证温度对水解平衡的影响
验证温度对水解平衡的影响
已知:①Cu2++4NH3·H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2分解的催化剂)
②A和C中的硫酸溶液浓度相同

下列有关分析错误的是
|
|
|
|
A.灼烧碎海带 | B.电镀银 | C.氧化还原反应滴定 | D.制备乙酸乙酯 |
选项 | 实验 | 现象 | 结论 |
A | 将打磨后的镁条放盛入有稀盐酸的试管中 | 用手触摸试管外壁感觉变热 | 镁条与稀盐酸反应是放热反应 |
B | 向某溶液中加铜和稀H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
D | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[ Cu(OH)2] |

A | B | C | D | |
装置 |
|
|
|
|
目的 | 干燥CO2 | 提纯乙酸乙酯 | 发生铝热反应 | 制取Cl2 |
实验记录如下:
|
|
实验现象 |
|
|
实验Ⅰ |
|
极少量 |
|
实验Ⅱ |
|
部分 |
|
实验Ⅲ |
|
|
初始阶段,
被氧化的反应速率:实验Ⅰ
填“
”“
”或“
”
实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
蓝色
或
无色
, 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入
, 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤
的目的是。
查阅资料,
,
无色
容易被空气氧化。用离子方程式解释步骤
的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
, 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓
溶液,
填实验现象
, 观察到少量红色的铜。分析铜未完全反应的原因是。


已知:①金属的化学性质和
相似,
的熔点为
;
②(乙醚)和
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
55.7 |
34.6 |
42.4 |
365.8 |
回答下列问题:

步骤一:向三颈烧瓶中加入少量磁力搅拌子,再加入10.00mL(密度为1.26g/mL)CS2。
步骤二:用恒压滴液漏斗向三颈烧瓶中加入50mLl.00mol/L的Na2S溶液,再向球形冷凝管中通入冷水,打开磁力搅拌器和加热装置,控制温度在25℃反应15min,关掉磁力搅拌器和加热装置。待溶液冷却后, (实验操作),得M的溶液,通过处理后得M晶体(Na2CS3·xH2O)。

步骤三:再将温度分别控制在30℃、35℃、40℃、45℃,重复以上操作,可得反应温度对全硫碳酸钠产率的影响如图乙;硫化钠和二硫化碳分别在40℃和45℃反应时,反应时间对全硫碳酸钠产率的影响如图丙。

已知:CS2易燃,有毒,不溶于水,沸点为46℃,能与NaOH溶液反应。
回答下列问题:
步骤一三颈烧瓶中加入的CS2是否过量(填“是”或“否”),发生反应的化学方程式为:。
M溶液显碱性的原因是(用离子方程式表示)。

已知:①粗锌中含有少量Cu和FeS。
②Li2S易潮解,在加热条件下易被空气中的O2氧化。
请回答下列问题:

下列有关说法正确的是 (填标号)。
A.采用如图装置过滤的优点是避免析出ZnSO4·7H2O
B.采用如图装置过滤主要是分离FeSO4·7H2O和ZnSO4溶液
C.粗皓矾晶体中可能含少量CuSO4·5H2O杂质
D.洗涤时采用乙醇的原因是减小ZnSO4·7H2O溶解损失
通过查阅资料有两种方案可以制备:
方案1:铜屑与在浓盐酸中反应;
方案2:铜丝在氯气中燃烧。
方案1的实验原理如图所示。

①仪器a的名称:。
②请写出方案1的反应原理:(用离子方程式表达)。
已知:①电石的主要成分是 , 还含有少量硫化钙;
②HCN易挥发,有毒,具有较强的还原性。

的电子式:。

请回答下列问题:
①Na2S溶液、BaCl2溶液、NaOH溶液
②BaCl2溶液、Ba(NO3)2溶液、NaOH溶液
③KMnO4溶液、BaCl2溶液、NaOH溶液
探究Ⅰ:为验证熔渣的成分,取分离出的熔渣少许于试管中,加入适量的稀硫酸溶解,取两份所得液。
完成表中横线上的内容。
试样 | 加入试剂及操作 | 实验现象 | 得出结论 | 离子反应方程式 |
第一份 | 滴入几滴溶液 | 试剂褪色 | 含FeO | |
第二份 | 滴入几滴溶液 | 溶液变为血红色 | 含Fe2O3 |
探究Ⅱ:设计实验方案验证泡铜中是否含有Cu2O?。
探究Ⅲ:煅烧的固体直接加稀硫酸,以上两个实验都达不到实验目的原因(用离子方程式表示)。