A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
|
试剂 |
操作步骤 |
发生现象 |
结论 |
|
①氢氧化铜 |
A.将尿液与试剂混合振荡 |
甲.蓝色溶液 |
|
|
乙.生成绿色沉淀 |
|
||
|
②斐林试剂 |
B.将尿液与试剂混合后加热至沸腾 |
丙.生成黄绿色沉淀 |
|
|
③硫酸铜 |
C.将尿液与试剂混合后微热 |
丁.生成黄色沉淀 |
|
|
戊.生成砖红色沉淀 |
|
将7.4 g某有机物A置于氧气流中充分燃烧,实验测得:生成9.0 g H2O和17.6 g CO2。
则该物质的最简式是,据此 (填“能”或“不能”)确定该有机物的分子式。若前一空选填“能”,请在后面横线上写出其分子式;若前一空选填 “不能”,请在后面横线上写出理由:。
核磁共振氢谱显示该有机物A分子内有2种不同环境的氢原子,且A能与金属钠反应放出无色无味的气体,则A的结构简式为。
A在浓硫酸作用下加热至一定温度可生成不饱和烃B,请写出B发生加聚反应的反应方程式: 。

①甲同学的操作是:取一小烧杯,加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:(填“甲”、“乙”或“丙”),发生的化学反应方程式是。

①准确量取25.00mL样品溶液的玻璃仪器是;第二次滴定达到终点的现象是。
②以M为草酸亚铁晶体的相对质量,该样品的纯度为(用代数式表示),若配制溶液时被氧化,则测定结果将(填“偏高”“偏低”或“不变”)。


|
化学键 |
|
|
N—H |
O—H |
|
|
键能 |
a |
b |
c |
d |
e |

已知:冷却结晶过程中得到的产物随温度不同会带不同数目的结晶水,如下表:
| 碘酸钙存在形式 | Ca(IO3)2 | Ca(IO3)2·H2O | Ca(IO3)2·6H2O |
| 稳定温度 | >57.5℃ | 32~57.5℃ | <32℃ |
请回答:


a、加水微热溶解试样,冷却后转移到250mL容量瓶,用水稀释至刻度,摇匀得试液
b、加入1:1高氯酸微热溶解试样,冷却后转移到250mL容量瓶,用水稀释至刻度,摇匀得试液
c、加50mL水,用浓度为0.100mol/L Na2S2O3标准溶液滴定至浅黄色
d、加50mL水,用浓度为0.100mol/L Na2S2O3标准溶液滴定至浅黄色,加入2mL淀粉溶液
e、准确量取50.00mL试液于250mL碘量瓶(如右图)中,加入3g碘化钾,盖上瓶塞,暗处反应3min
f、准确量取50.00mL试液于250mL锥形瓶中,加入3g碘化钾,暗处反应3min
g、继续用Na2S2O3标准溶液滴定,至浅黄色溶液变为无色,半分钟内不恢复,读数
h、继续用Na2S2O3标准溶液滴定,溶液蓝色消失,半分钟内不恢复,读数

乙二胺缩写为en,实验过程含钴离子依次发生如下变化:[Co(H2O)6]2+→[Co(en)2(H2O)2]2+→[Co(en)2(H2O)2]3+→[Co(en)2Cl2]+
![]()

①由上述实验可知;生成trans-[Co(en)2Cl2]Cl是决速(填“热力学”或“动力学”,下同),生成cis-[Co(en)2Cl2]Cl是决速。
②设计实验将cis-[Co(en)2Cl2]Cl转化为trans-[Co(en)2Cl2]Cl。

已知:锰酸钾(K2MnO4)是墨绿色晶体,水溶液呈深绿色(MnO的特征颜色),在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO
会发生歧化反应生成MnO2和MnO
。
①煅烧KOH和软锰矿的混合物应放在(填“瓷坩埚”“蒸发皿”或“铁坩埚’)中加热,发生反应的化学方程式为。
②设计实验方案验证K2MnO4歧化反应是否完全:。
I.将一定量的高锰酸钾加入烧杯中,倒入蒸馏水使其溶解;
II.取0.100mol·L-1的草酸标准溶液25.00mL置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗VmLKMnO4溶液。
①高锰酸钾溶液盛放在(填“酸式”或“碱式”)滴定管中。
②滴定到达终点的现象是。
③该KMnO4溶液的物质的量浓度为mol·L-1。

回答下列问题:
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4

①装置A中反应的化学方程式为。
②欲收集干燥的ClO2 , 选择图中的装置,其连接顺序为a→(按气流方向,用小写字母表示)。
③装置D的作用是。
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。

操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中,滴加品红溶液和盐酸。 | 品红始终不褪色 | ①无生成 |
另取少量Ⅰ中溶液于试管乙中,加入Ba(OH)2溶液,振荡。 | ② | 有 |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,。 | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为。

写出装置乙中2PbCO3·Pb(OH)2发生反应的离子方程式(已知生成白色沉淀):。
实验步骤:①称取胡粉样品a g;②将样品充分煅烧,冷却后称量;③重复操作②,测得剩余固体质量为b g。
下列仪器,方案Ⅱ不需要使用的是(用对应仪器的字母填空)。
①如图所示,连接好装置并检查气密性;
②向量气管中注入饱和NaHCO3溶液,并调节两侧液面相平,称取胡粉样品m g于锥形瓶中,打开分液漏斗活塞,将稀硫酸滴入锥形瓶中;
③待反应完全后, , 调节B与C中液面相平,平视读数,测得气体体积为VmL。
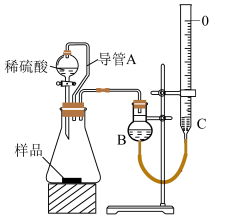
③中所留空的操作为,导管A的作用为。
方法①:金属直接氮化法:2Al+N22AlN或者2Al+3NH3
2AlN+3H2;
方法②:氧化物还原氮化法:Al2O3+3C+N22AlN+3CO;
方法③:化学气相沉积法等。

仪器B的名称;装置中橡胶导管A的作用是。

①广口瓶中的试剂X最好选用(填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②下列措施或事实造成测定氮化铝样品的质量分数偏小的是。(填写序号)。
a.广口瓶中的液体没有装满 b.量筒的液面高于试剂X的液面
c.氨气没有全部进入广口瓶 d.撤走橡胶导管E,并将锥形瓶塞改为双孔塞
③若实验中称取氮化铝样品的质量为1.00g,测得氨气的体积336mL(标准状况),则样品中AlN的质量分数为。(保留3位有效数字)。

已知:步骤II中发生的刷反应,AlCl3+nNH3AlCl3•nNH3
步骤III中发生的主反应化学方程式:。

则其结构简式为。

步骤:
① 搭建装置,检测装置的气密性;
② 准确称取4.3g样品有机物G放于电炉中;
③ 打开分液漏斗活塞,让A装置反应一段时间后;
④ 电炉通电,充分燃烧后产物只有水和二氧化碳,且被充分吸收;
⑤ 样品完全燃烧后,电炉断电,继续让A装置反应一段时间后再停止;
⑥ 测定装置D质量增加2.7g,U形管E质量增加8.8g;
⑦ 拿样品G去相关机构做质谱、红外光谱和核磁共振氢谱,谱图如下所示。

回答下列问题:


结合M的红外光谱图(图2)及核磁共振氢谱图(图3),综合分析得出M的结构简式为_。
