选项 | 劳动项目 | 化学知识 |
A | 工厂用铁罐车运输浓硫酸 | 浓硫酸很难电离出H+ , 与铁不反应 |
B | 将铁闸门与直流电源的负极相连 | 利用牺牲阳极法保护铁闸门不被腐蚀 |
C | 陶瓷表面上釉 | 隔绝空气,防止陶瓷被氧化 |
D | 消防演练用泡沫灭火器灭火 | Al3+与 |


 测定中和反应的反应热
B .
测定中和反应的反应热
B .  铜的电解精炼
C .
铜的电解精炼
C .  验证电解饱和NaCl溶液(含酚酞)的产物
D .
验证电解饱和NaCl溶液(含酚酞)的产物
D .  在铁制品上镀铜
在铁制品上镀铜
①环境中的Cl﹣扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为;
②若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为L(标准状况).

(ⅰ)取三支试管,标记为I、II、III,I中盛有适量蒸馏水,II中盛有适量蒸馏水和植物油,III洁净干燥
(ⅱ)在三支试管中各放入一根无锈铁钉.并将II和III用软木塞塞紧,III中放入一小团棉花(如图所示).请回答:

由此可以得出铁钉锈蚀的条件有和.
若该同学将I放在每天阳光直晒的阳台上,与避光保存相比,哪种保存方法锈蚀更快?这说明锈蚀速度与什么因素有关?
若该同学将I中的液体换做食盐水,对锈蚀的速率有何影响?这说明锈蚀速率还和什么因素有关?.
实验序号 | 实验装置 | 实验方案 | 实验现象 |
实验一 |
| 将 | |
将一个铁钉用砂纸打磨光滑,一端缠有铜丝,放入培养皿中一段时间。 | 铜丝的区域溶液变红色;铁钉区域出现蓝色沉淀。 |
①请解释铜丝区域溶液变红的原因是。
②写出生成蓝色沉淀的离子方程式。
实验序号 | 实验方案 | 实验现象 |
实验二 | 取 | 滴入 |
根据实验二的现象,推测可能具有“填氧化性或还原性”。
实验序号 | 实验装置 | 实验方案 | 实验现象 |
实验三 |
| 取 | 溶液无明显变化 |
继续向试管中加入少许 | 一段时间后,铁片表面产生大量的蓝 |
根据实验现象推出实验三的结论是:在溶液中情况下,。
①补全实验方案2中的空格部分
|
实验序号 |
实验装置 |
实验方案 |
实验现象 |
|
实验四 |
|
1.按图连接好装置,准确读取电流表读数。 |
电流表指针偏转,读数为I |
|
2.取于试管中,加入溶液,振荡。 |
产生蓝色沉淀。 |
②思考:若电极X为时,电流表读数为
, 推测电极X为
时电流表读数的范围是。
锌棒上发生的电极反应为;铁棒上发生的电极反应为。
实验Ⅱ中电流表指针的偏转方向与实验Ⅰ(填“相同”或“相反”)。

Cu2(OH)3Cl属于(填“无害锈”和“有害锈”),请解释原因。

①过程I的正极反应物是。
②过程I负极的电极反应式是。
i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl- , 能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”

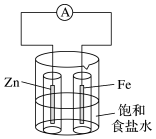
①Zn电极为电池的(填“正极”或“负极”)。
②写出电极反应式:Zn电极,Cu电极。
③盐桥中向CuSO4溶液中迁移的离子是(填离子符号)。

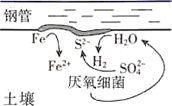
①图1中被腐蚀的金属为(填化学式);图2中金属腐蚀类型属于(填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是(填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为。
![]()
①B的化学式;D的颜色。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式。
①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母标号)。
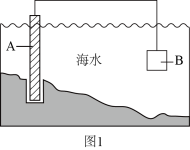
a.碳棒 b.锌板 c.铜板
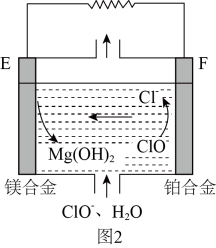
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的(填“正”或“负”)极。F电极上的电极反应式为。