已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:

①(CN)2与KOH溶液反应的化学方程式:。
②在NaBr和KSCN的混合溶液中滴加少量(CN)2 , 反应的离子方程。

①硅除用于制造芯片外,在能量转化方面也有极为重要的用途,该用途是(填一种),写出制备粗硅反应的化学方程式:。
②过程②是置换反应,则该反应中得到的单质为(填化学式)。
X的化学式是,按照物质的组成和性质分类,属于(填字母)。
A.单质 B.酸性氧化物 C.化合物 D.盐

工业上常用于沉淀的廉价试剂①的俗名是。操作Ⅰ的名称是。

步骤B需搅拌、加热煮沸的目的是。步骤C中反应的离子方程式为

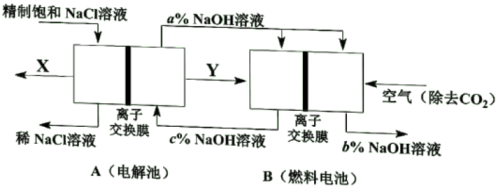
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。


当有3molBr2参加反应,发生转移的电子的物质的量为。

i.反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是;2min时,反应是否达到化学平衡状态(填“是”或“否”)。
ii.关于该反应下列说法不正确的是。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
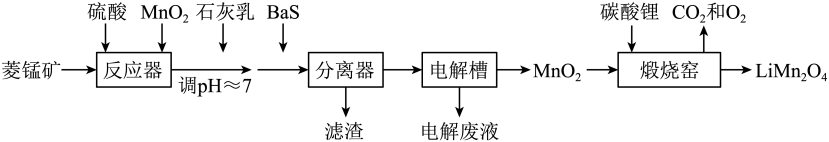
“浸锰”过程中,发生反应
, 则可推断:
填“
”或“
”
。
在
溶液中,银锰精矿中的
和氧化锰矿中的
发生反应,则浸锰液中主要的金属阳离子有。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中
的作用:。
该步反应的离子方程式有。
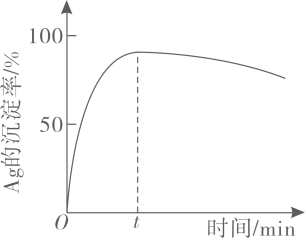
一定温度下,
的沉淀率随反应时间的变化如图所示。解释
分钟后
的沉淀率逐渐减小的原因:。

①Cr原子的价电子排布式为。
②实验前先往装置A中通入 , 其目的是排尽装置中的空气,在实验过程中还需要持续通入
, 其作用是。
③装置C的水槽中应盛有(填“冰水”或“沸水”)。
④装置B中还会生成光气(),B中反应的化学方程式为。
|
|
在不同温度下的反应现象 |
|
|
25℃ |
90-100℃ |
|
|
1 |
紫红色 |
蓝绿色溶液 |
|
2~9 |
紫红色 |
黄绿色溶液,且随 |
|
10 |
紫红色 |
澄清的橙黄色溶液 |
|
11~23 |
紫红色 |
橙黄色溶液,有棕褐色沉淀,且随 |
|
24~25 |
紫红色 |
紫红色溶液,有较多的棕褐色沉淀 |
①温度对反应的影响。
与
在常温下反应,观察不到
离子的橙色,甲同学认为其中一个原因是
离子的橙色被
离子的紫红色掩盖,另一种可能的原因是,所以必须将反应液加热至沸腾4~5min后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
②与
的用量对反应的影响。
对表中数据进行分析,在上述反应条件下,欲将氧化为
,
与
最佳用量比为。这与由反应
所推断得到的用量比不符,你推测的原因是。

一些难溶物开始沉淀和完全沉淀的 pH 如表所示:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀 pH(离子初始浓度为 0.01mol·L-1) | 4 | 2.3 | 10.4 |
完全沉淀 pH(离子浓度<10-5mol·L-1) | 5.2 | 3.2 | 12.4 |
请回答下列问题:
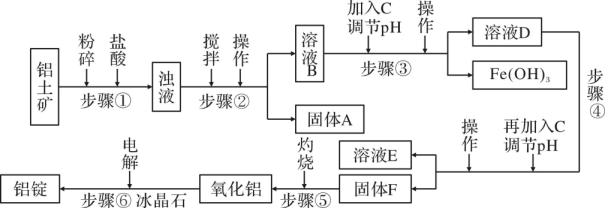
a.Fe b.氨 c.过量氢氧化钠稀溶液

已知:①浸出液中含有的金属离子主要有、
、
、
。
②氧化性。
③、
、
、
。溶液中金属离子物质的量浓度低于
mol/L时,可认为沉淀完全。
②写出除杂过程中参与反应的化学方程式。
③调pH过程中加调节后会生成两种沉淀,同时得到的滤液中
mol/L,调节pH的范围为。


资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而-OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
①1mol乙醇分子中的极性共价键有mol。
②从结构角度解释乙醇的沸点比乙烷高的原因 。
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 。
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。

该流程中能循环使用的物质是。